聚焦巨噬细胞焦亡──模型制备技巧与全流程解决方案
Source: Elabscience®Published: 2025-07-15
细胞焦亡(pyroptosis)作为一种炎症性程序性死亡形式,在感染、自身免疫病及肿瘤免疫等领域已成为研究热点。其分子机制由Gasdermin(GSDM)蛋白家族介导,通过质膜孔道形成引发细胞裂解和促炎因子释放,在免疫防御与病理损伤中具有"双刃剑"效应。
巨噬细胞作为连接固有免疫与适应性免疫的关键效应细胞,其焦亡研究近年取得显著进展。例如,康涅狄格大学(University of Connecticut)团队发现,焦亡巨噬细胞释放的细胞外囊泡(EV)携带功能性GSDMD孔道结构,可转移至邻近细胞质膜并诱导次级死亡,形成级联炎症放大效应,这一机制揭示了急性呼吸窘迫综合征(ARDS)与自身免疫病中"多米诺骨牌式"组织损伤的新病理基础。在移植物抗宿主病研究中,供体来源巨噬细胞的焦亡被证实可驱动急性移植物抗宿主病(aGVHD)的发展;而在肿瘤治疗领域,焦亡诱导型自适应剂通过重编程肿瘤浸润巨噬细胞,显著增强乳腺癌免疫治疗的疗效。
当前国家自然科学基金项目中,围绕巨噬细胞焦亡的基础分子机制解析、疾病关联研究及靶向药物开发已成为重点方向。其中,体外巨噬细胞焦亡模型的建立,为深入探究该死亡形式的调控机制及其在疾病中的作用提供了关键实验工具。
一、实验原理
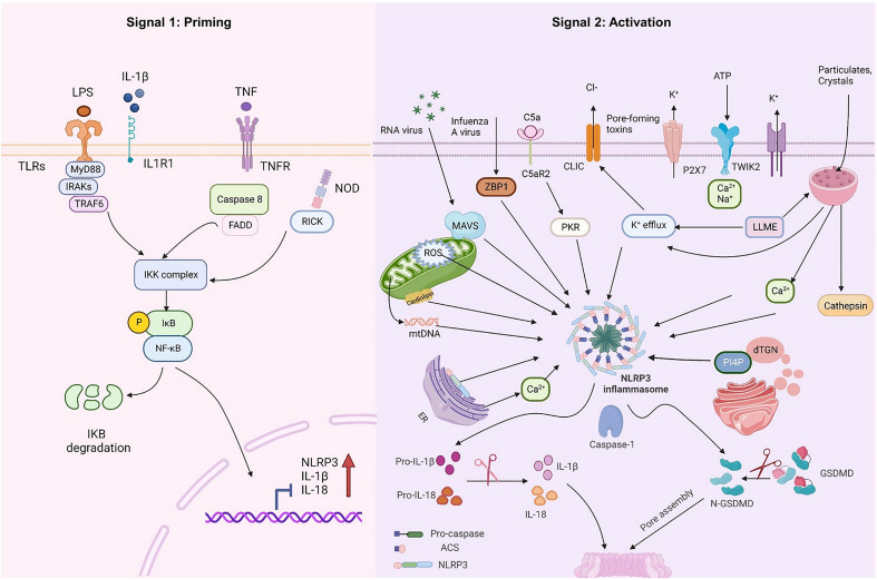
脂多糖(LPS)可通过经典途径与Toll样受体4(TLR4)结合,经MyD88/TRIF接头蛋白激活核因子κB(NF-κB)通路,促进NLRP3炎症小体组装并触发细胞焦亡;此外,LPS还可通过非经典途径直接激活caspase 4/5(人源)或caspase 11(鼠源),进而裂解Gasdermin D(GSDMD)介导焦亡。
三磷酸腺苷(ATP)作为损伤相关分子模式(DAMP),通过结合细胞膜嘌呤能受体(如P2X7受体)发挥作用。P2X7受体激活后形成跨膜孔道,主要介导钾离子外流,进而激活NLRP3炎症小体。活化的NLRP3炎症小体募集并活化caspase 1,最终裂解GSDMD诱导细胞焦亡。(PMID: 37180116和33713214)
二、实验结果
01 Raw264.7细胞焦亡的形态学观察
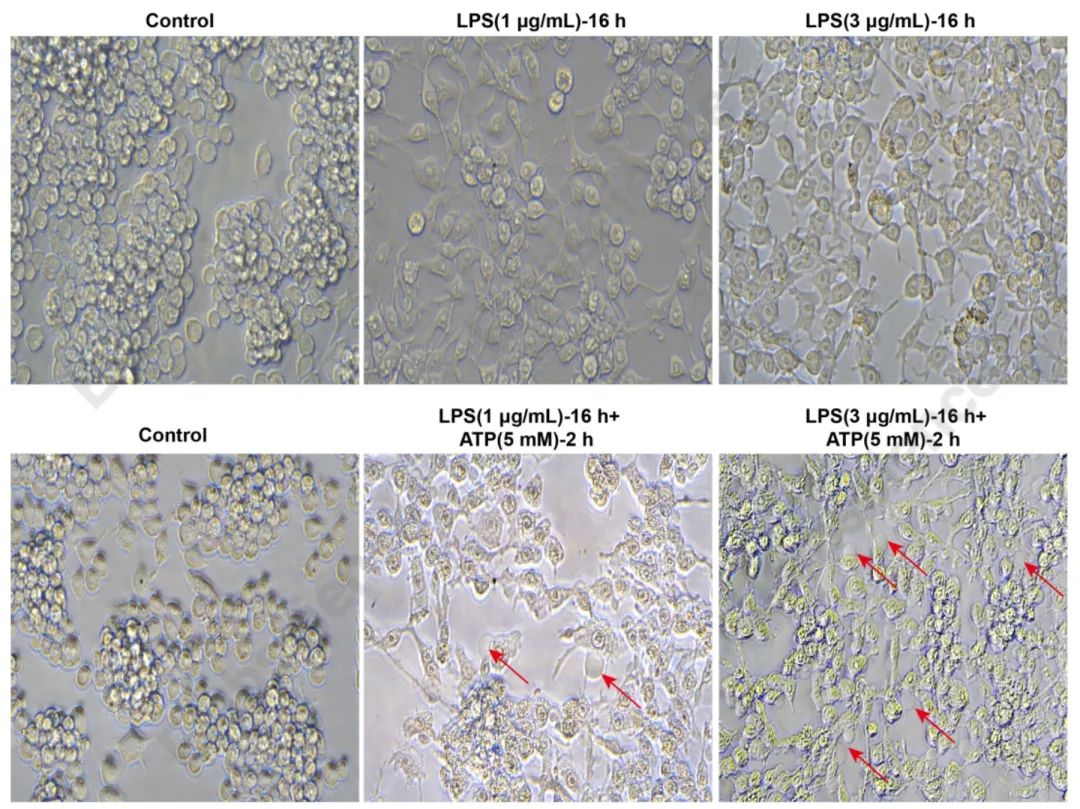
图1. 如图所示,单独添加LPS诱导培养Raw264.7细胞16 h,显微镜下观察,Raw264.7细胞内颗粒度增加,但未观察到明显的吹气球样出泡的焦亡典型症状,加入ATP(5 mM)共同诱导培养细胞2 h后,镜下可观察到明显的焦亡细胞的出泡现象(红色箭头指示)。(细胞发生焦亡的典型形态学特征:细胞膨大变形,细胞器变形,焦亡小体形成,细胞吹气球样出泡,细胞膜孔隙破裂。)
02 Raw264.7细胞焦亡的caspase 1酶活检测和ROS检测
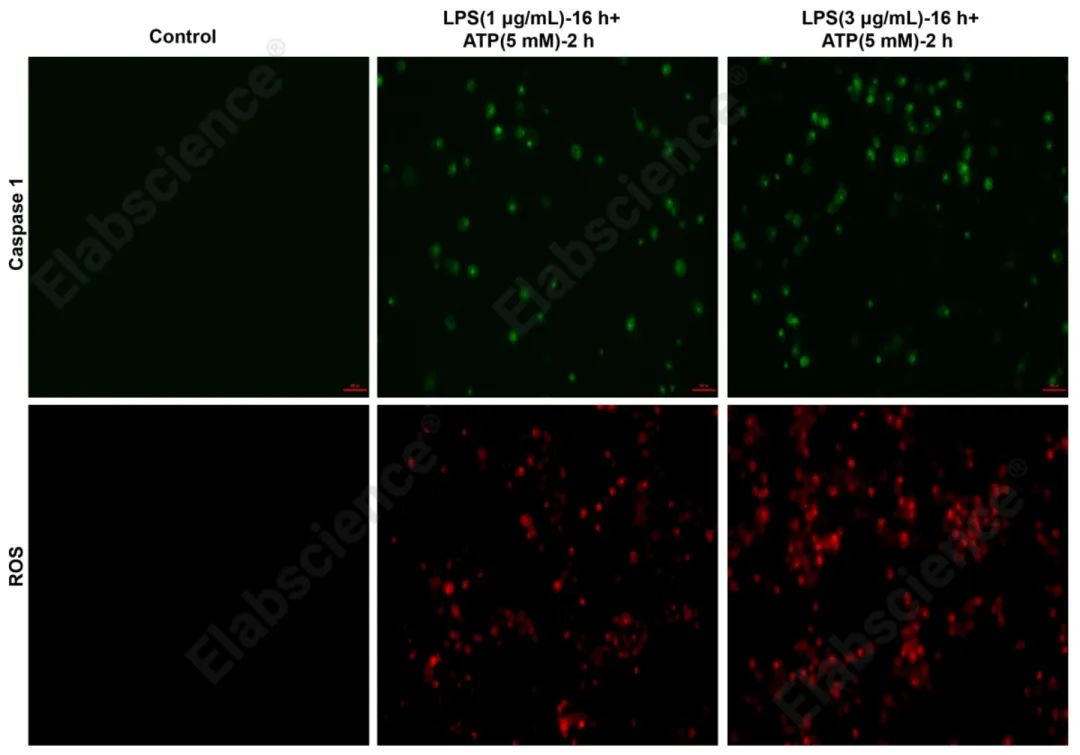
图2. Raw264.7细胞使用LPS和ATP共同诱导焦亡后,使用caspase 1探针(E-CK-A481)和ROS探针(E-BC-F005)孵育并使用荧光显微镜拍照。
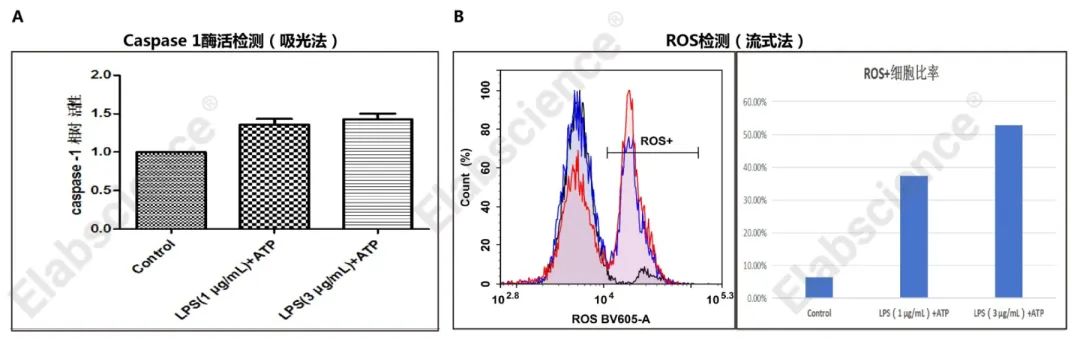
图3. Raw264.7细胞使用LPS和ATP共同诱导焦亡后,使用caspase 1吸光法试剂盒(E-CK-A381)和ROS探针(E-BC-F005)检测使用流式细胞仪分析结果,由图可知,焦亡细胞中caspase 1酶活显著增强,ROS累积显著增加,且吸光法和流式法检测的caspase 1和ROS结果与图1中荧光法检测结果一致。
03 Raw264.7细胞焦亡的LDH检测和炎症因子检测
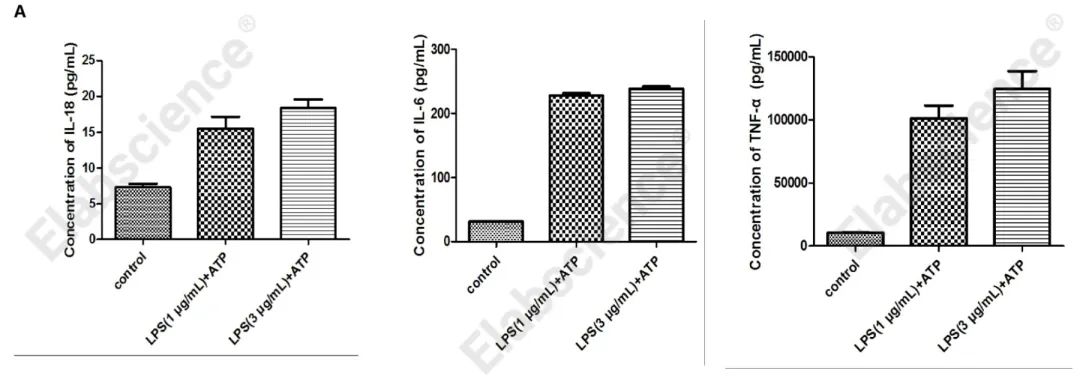
图4. 如图所示,Raw264.7细胞使用LPS和ATP共同诱导焦亡后,收集细胞上清,使用小鼠IL-18/IL-6/TNF-α ELISA检测试剂盒(E-EL-M0730、E-EL-M0044、E-EL-M3063)检测并分析结果,焦亡细胞上清中分泌释放的细胞因子IL-18、IL-6、TNF-α明显增加。
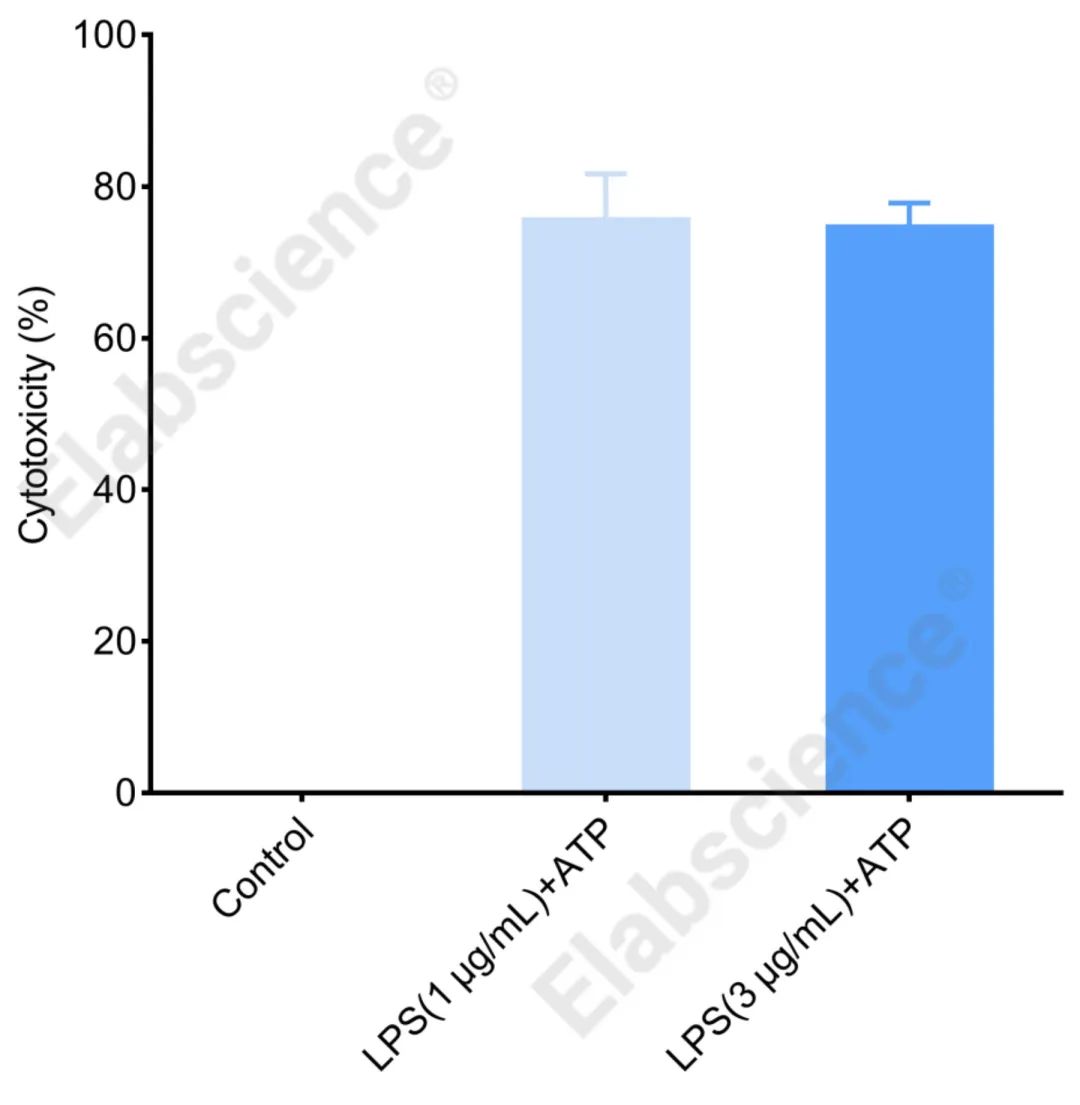
图5. 如图所示,Raw264.7细胞使用LPS和ATP共同诱导焦亡后,收集细胞上清,使用LDH细胞毒性检测试剂盒(E-BC-K771-M)检测并分析结果,焦亡细胞释放的LDH明显增加。
综上所述,LPS和ATP协同作用可显著诱导Raw264.7细胞发生焦亡,激活细胞内的Caspase 1酶,促进NLRP3焦亡小体的生成,进一步促进细胞内ROS的累积和LDH增加,促进炎症因子IL-18、IL-6、TNF-α等的释放。
三、实验方案
01 试剂配制
使用无菌PBS配制ATP母液5M,过滤分装-20℃冻存。使用无菌PBS配制LPS,-20℃保存。
02 细胞模型制备
收集正常生长的小鼠单核巨噬细胞Raw264.7,加入RPMI-1640全培养基调整细胞密度到2.5-5×105/mL,接种于24孔板或6孔板,置入37℃、5% CO2培养箱中过夜培养24 h。过夜培养后的细胞,观察细胞状态,细胞密度约达70%,加入终浓度为1-3 μg/mL的LPS,轻轻混匀,CO2培养箱中继续培养16 h后,再次加入终浓度为5 mM的ATP溶液激活培养2 h。
03 细胞焦亡检测
收集细胞沉淀及细胞上清,并进行相关指标检测。(详细样本制备及检测流程请参考相关产品说明书)
注:若有更多实验内容方面的细节需要了解,欢迎和我们技术团队沟通,点击联系技术支持!
四、相关试剂
|
产品名称 |
货号 |
|
半胱天冬酶1(Caspase-1)活性检测试剂盒(比色法) Caspase 1 Activity Assay Kit (Colorimetric Method) |
|
|
流式细胞术用半胱天冬酶1活性检测底物 Caspase 1 Activity Detection Substrate for Flow Cytometry |
|
|
活性氧(ROS)荧光检测试剂盒(红色荧光) Reactive Oxygen Species (ROS) Fluorometric Assay Kit (Red) |
|
|
乳酸脱氢酶(LDH)细胞毒性比色检测试剂盒 Lactate Dehydrogenase (LDH) Cytotoxicity Colorimetric Assay Kit |
|
|
小鼠肿瘤坏死因子α(TNF-α)ELISA检测试剂盒 Mouse TNF-α (Tumor Necrosis Factor Alpha) ELISA Kit |
|
|
小鼠白细胞介素6(IL-6)ELISA检测试剂盒 Mouse IL-6(Interleukin 6) ELISA Kit |
|
|
小鼠白细胞介素18(IL-18)ELISA检测试剂盒 Mouse IL-18(Interleukin 18) ELISA Kit |
五、更多体外模型处理方案参考
细胞焦亡常用的诱导剂以及体外研究的焦亡模型推荐以下:
常用诱导剂和抑制剂
常用诱导剂:
LPS:参与非经典途径,激活caspase 4/5裂解GSDMD;
Nigericin Sodium/Nig:NLRP3炎症小体的激活剂;
Raptinal:直接激活Caspase 3并在多个细胞系中启动内在的Caspase依赖性凋亡途径。
常用抑制剂:
Disulfiram:有效抑制GSDMD孔形成从而抑制细胞焦亡。
细胞焦亡模型
LPS和ATP诱导Raw264.7/THP-1/J774A.1细胞焦亡模型:1-3 μg/mL的LPS诱导16 h再加入加入终浓度为5 mM的ATP溶液激活培养2 h(注:THP-1细胞需要先使用PMA诱导过夜成巨噬细胞后再进行焦亡诱导)。
LPS诱导Hacat细胞焦亡模型:1 μg/mL的LPS诱导16 h。
注:不同的细胞诱导对于焦亡诱导试剂的剂量依赖性不同,请根据具体的细胞模型进行诱导试剂浓度和诱导时间的梯度测试。
参考文献:
[1] Burdette B E, Esparza A N, Zhu H, et al. Gasdermin D in pyroptosis[J]. Acta Pharmaceutica Sinica B, 2021, 11(9).DOI:10.1016/j.apsb.2021.02.006.
[2] Zheng X, Wan J, Tan G. The mechanisms of NLRP3 inflammasome/pyroptosis activation and their role in diabetic retinopathy[J]. Frontiers in Immunology, 2023, 14.DOI:10.3389/fimmu.2023.1151185.
[3] Murao A, Aziz M, Wang H, et al. Release mechanisms of major DAMPs[J]. Apoptosis, 2021(Suppl 1).DOI:10.1007/s10495-021-01663-3.