巨噬细胞研究热点及解决方案:Raw264.7/BMDM/THP-1定向极化M1和M2秘籍
Source: Elabscience®Published: 2025-09-23
在巨噬细胞研究中,细胞模型是至关重要的实验工具。根据不同的研究需求,常通过特定细胞因子或刺激条件将巨噬细胞诱导为M1型(促炎型)或M2型(抗炎/修复型),进而用于在体外研究药物作用、各类因子的影响以及细胞内代谢机制等研究。常用的巨噬细胞模型包括小鼠来源的Raw264.7、BMDM(骨髓来源巨噬细胞)和J774A.1,以及人源的THP-1细胞等。其中,THP-1细胞常经PMA等诱导剂处理后分化为巨噬细胞样状态,再进一步进行极化操作。M1/M2极化过程及机制如下图所示:
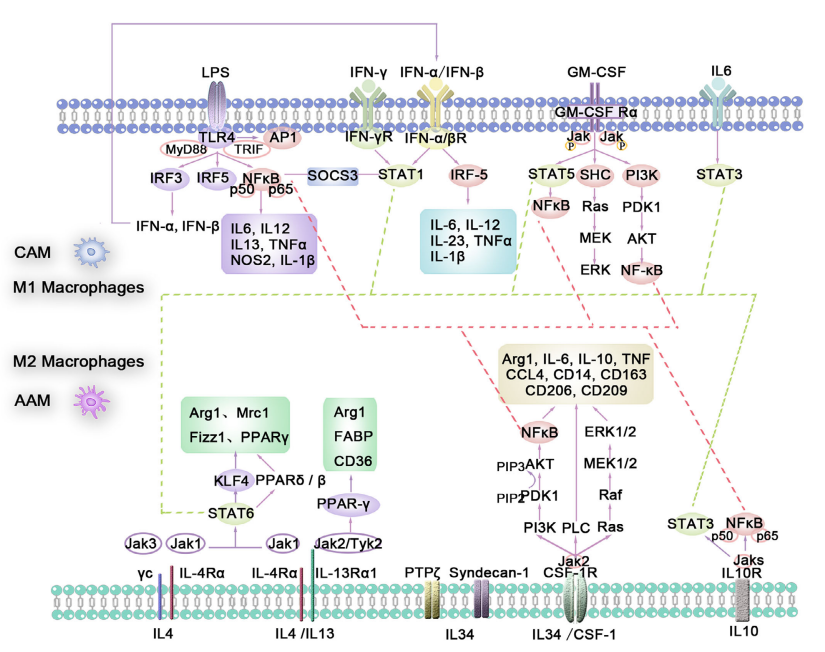
图1. 巨噬细胞极化机制
一、巨噬细胞模型制备流程及检测方案
1、Raw264.7极化M1流程及检测方案
详细流程和Protocol请参考M1型Raw264.7巨噬细胞极化培养和检测试剂盒(XJM004)说明书。
2、BMDM极化M1和M2流程及检测方案
A.试剂准备:BMDM专用培养基配制。在RPMI 1640基础培养基中(PM150114,Procell),加入终浓度为2 mM的L-丙氨酰-L-谷氨酰胺溶液、终浓度为100 U/mL的青霉素溶液、终浓度为100 μg/mL的链霉素溶液和终浓度为10%的特优级胎牛血清。配制好后4℃分装保存,1个月内使用完毕。
B.细胞处理:
(1)C57小鼠实施安乐死,用75%乙醇浸泡。
(2)在超净台中,将小鼠置于10 cm培养皿中,用剪刀去除皮肤,露出小腿,剪掉靠近下肢根部的主要肌肉,露出髋关节。切开股骨底部附近,切断跟腱,移除股骨周围的主要肌肉。
(3)在膝关节处切割,去除胫骨周围的主要肌肉,去除腓骨。
(4)去掉股骨和胫骨的骨痂,在6 cm培养皿中加入BMDM专用培养基(1640基础+10%FBS+1%P/S+1%L-丙氨酰-L-谷氨酰胺(100×)),用1 mL注射器将骨髓细胞吹出,用滤网过滤到15 mL的离心管中。
(6)300×g离心5 min。加入1mL 1×ACK Lysis Buffer,轻轻吹打混匀,室温静置30 s。
(7)用10 mL PBS终止裂解,300×g离心5 min,弃上清。
(8)用10 mL BMDM专用培养基重悬细胞沉淀,细胞计数。
C.M1和M2巨噬细胞的培养:
(1)调整细胞密度到2×105个/mL,接种细胞到细胞培养皿中,加入M-CSF(20 ng/mL),置于37℃ 5% CO2培养箱培养72 h。
(2)每日在显微镜下观察细胞状态并拍照,培养72 h后,将培养皿中的细胞培养液弃去,留取贴壁细胞。
(3)补充全培养基,加入LPS(300 ng/mL)和IFN-γ200 ng/mL)到诱导M1巨噬细胞的培养皿中,加入M-CSF(20 ng/mL)、IL-4(20 ng/mL)和IL-13(20 ng/mL)到诱导M2巨噬细胞的培养皿中,置于37℃,5% CO2培养箱继续培养24 h。
D.细胞收集:
(1)将培养皿中的细胞培养液转移至15 mL离心管中,PBS浸洗细胞2次,弃去PBS,加入足量的0.25%胰蛋白酶溶液消化1 min(胰蛋白酶需将细胞完全覆盖)后迅速加入BMDM专用培养基终止消化。
(2)使用1 mL移液器轻轻吹打细胞使其脱落并转移到15 mL离心管中。100-250×g离心3-5 min,小心弃去上清。
(3)使用BMDM专用培养基重悬,细胞计数,进行表型鉴定或进入下游实验。
E.细胞检测:
(1)每管加入100 μL M1巨噬细胞和M2巨噬细胞(约2-5×105个细胞),加入1 mL Cell Staining Buffer或PBS缓冲液轻轻吹打混匀,100-250×g离心3-5 min,弃上清。
(2)加入100 μL Cell Staining Buffer或PBS缓冲液重悬细胞沉淀,每组加入1 μL Purified Anti-Mouse CD16/32 Antibody(1 mg/mL),轻轻吹打混匀,室温避光孵育15 min以封闭细胞表面的Fc受体。
(3)再加入各流式抗体,轻轻吹打混匀,4℃避光孵育30 min。
(4)孵育完成后,每管加入1 mL Cell Staining Buffer轻轻吹打混匀,100-250×g离心3-5 min,弃上清。
(5)每管用200 μL Cell Staining Buffer重悬细胞沉淀,上机检测。
3、THP-1极化M1和M2流程及检测方案
A.试剂准备:1640全培养基的配制。在RPMI 1640基础培养基中(PM150114,Procell),加入终浓度为100 U/mL的青霉素溶液和终浓度为100 μg/mL的链霉素溶液,终浓度为15%的特优级胎牛血清,配制好后4℃分装保存,1个月内使用完毕。
B.细胞处理:
(1)取生长状态良好的THP-1细胞,使用1640全培养基调整细胞密度至3×105/mL。
(2)按分组进行细胞铺板,6孔板中每孔加入2 mL细胞悬液,6 cm培养皿中每皿加入5 mL细胞悬液。
C.M1巨噬细胞的培养:
(1)按照细胞分组,Control组细胞不做处理,M1诱导组细胞中加入终浓度为(200 ng/mL)的PMA,轻轻吹打混匀,置于37℃ 5% CO2培养箱中继续培养24 h后,镜下观察M1组细胞呈圆形贴壁状。
(2)吸弃M1组细胞上清,加入1640全培养基浸洗2次弃上清,补充适量的全培养基(6孔板中每孔2 mL,6 cm培养皿中每皿5 mL)。
(3)加入终浓度为1 μg/mL的LPS和终浓度为200 ng/mL的IFN-γ,轻轻吹打混匀,置于37℃ 5% CO2培养箱中继续培养24 h。
D.M2巨噬细胞的培养:
(1)按照细胞分组,Control组细胞不做处理,M2诱导组细胞中加入终浓度为(200 ng/mL)的PMA,轻轻吹打混匀,置于37℃ 5% CO2培养箱中继续过夜培养20 h后,镜下观察细胞呈圆形贴壁状。
(2)吸弃M2组细胞培养上清,加入1640全培养基浸洗2次,弃上清。
(3)补充适量的全培养基(6孔板中每孔2 mL,6 cm培养皿中每皿5 mL),置于37℃ 5% CO2培养箱中静息培养24 h
(4)加入1 μg/mL的LPS和终浓度为50 ng/mL的IL-4和IL-13,轻轻吹打混匀,置于37℃ 5% CO2培养箱中继续培养24-48 h。
E.细胞的收集和检测:
(1)镜下观察细胞状态,M1和M2诱导组细胞弃去细胞培养上清,使用PBS浸洗3次。
(2)每孔加入足量的0.25%胰蛋白酶溶液(不含EDTA),置于37℃ 5% CO2培养箱中消化30-60 s。
(3)使用1 mL移液器轻轻吹打细胞,促进细胞脱落,迅速加入1640全培养基终止细胞消化,轻轻吹打并收集细胞到15 mL离心管中,100-250×g离心3-5 min,弃上清。
(4)使用100 μL Cell Staining Buffer或PBS缓冲液重悬细胞沉淀,加入Human Fc受体封闭剂,室温封闭15 min。
(5)加入表染指标抗体,4℃避光孵育30 min。
(6)孵育完成后,每管加入1 mL Cell Staining Buffer轻轻吹打混匀,100-250×g离心3-5 min,弃上清。
(7)200 μL Cell Staining Buffer重悬细胞沉淀,上机检测。
二、不同巨噬细胞极化检测结果
1、Raw264.7极化M1和M2型巨噬细胞检测结果
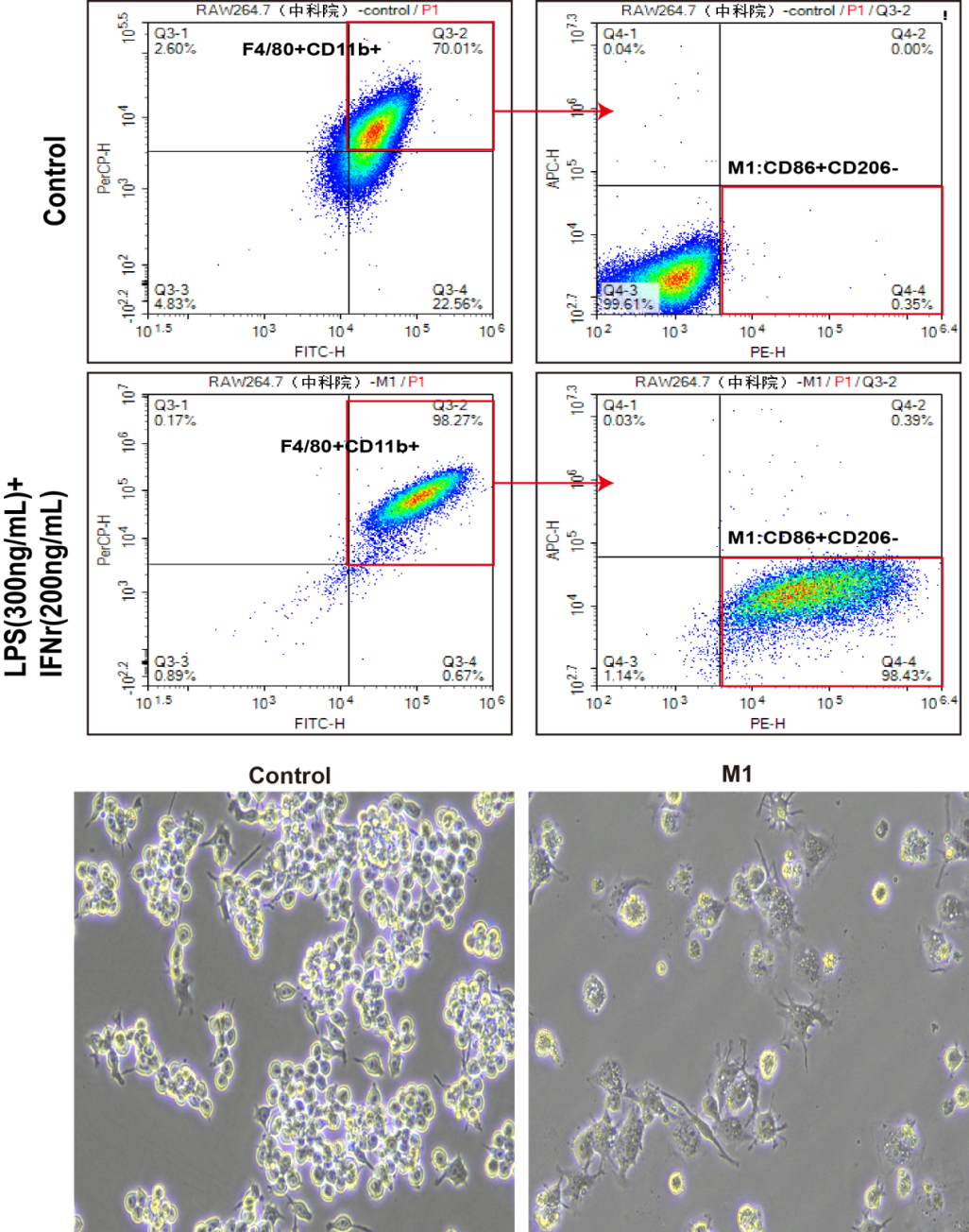
图2. Raw264.7细胞极化M1后使用Raw264.7巨噬细胞极化培养和检测试剂盒(XJM004)检测并分析结果。由图可见,和无处理的Control组细胞相比,M1巨噬细胞有短而密的伪足,细胞质内颗粒感明显增加,流式检测结果显示高表达F4/80、CD11b、CD86。
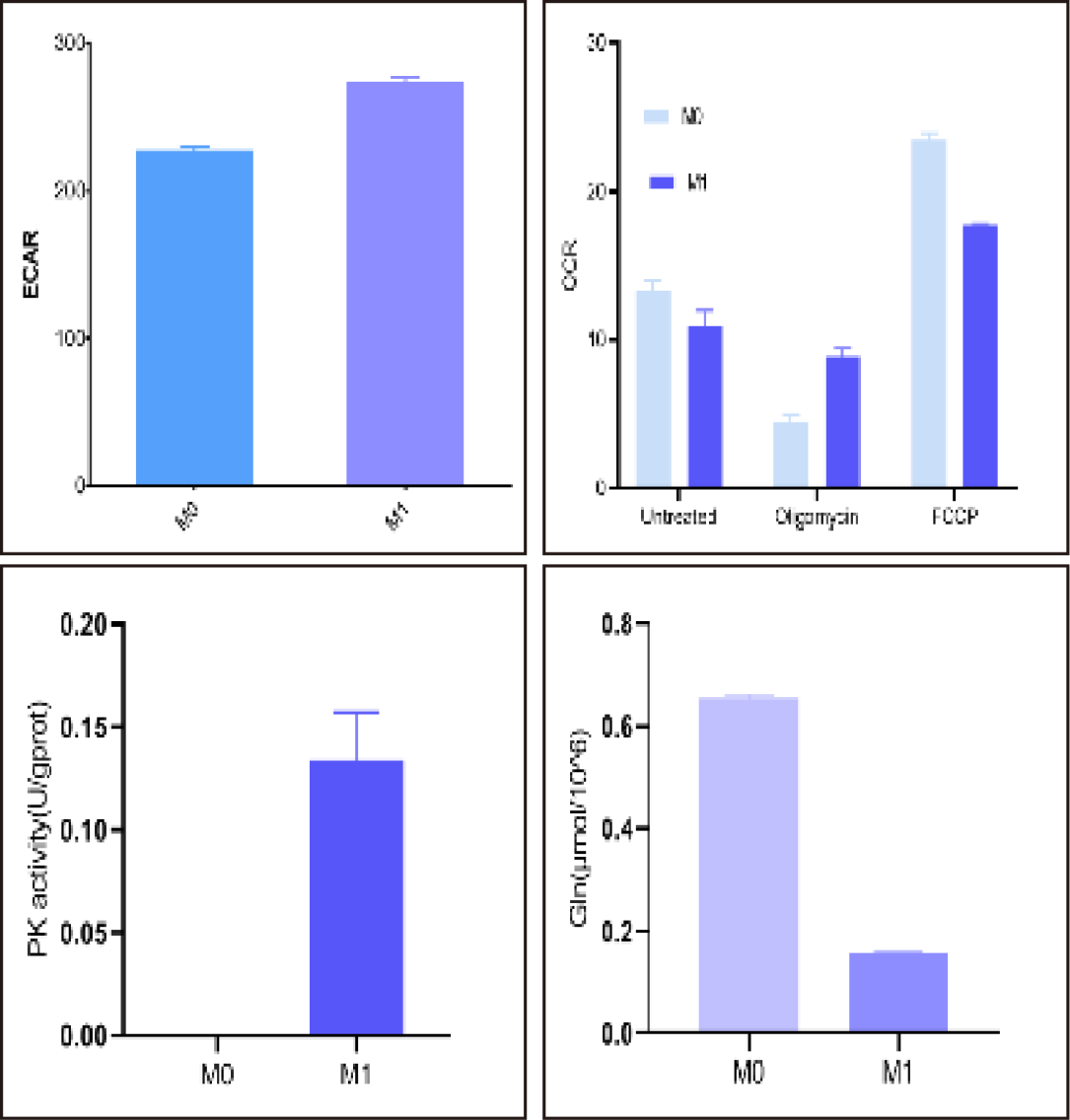
图3. RAW264.7巨噬细胞诱导M1型极化后检测ECAR(E-BC-F069)和OCR(E-BC-F068)。结果显示反应糖酵解速率的ECAR增加,反应氧消耗率的OCR减少,说明巨噬细胞M1极化过程中的能量依赖于糖酵解代谢增加;检测丙酮酸激酶(E-BC-K611-M)和谷氨酰胺(E-BC-K853-M),结果M1型极化增加丙酮酸激酶活性,减少细胞内的谷氨酰胺。
2、BMDM极化M1和M2型巨噬细胞检测结果
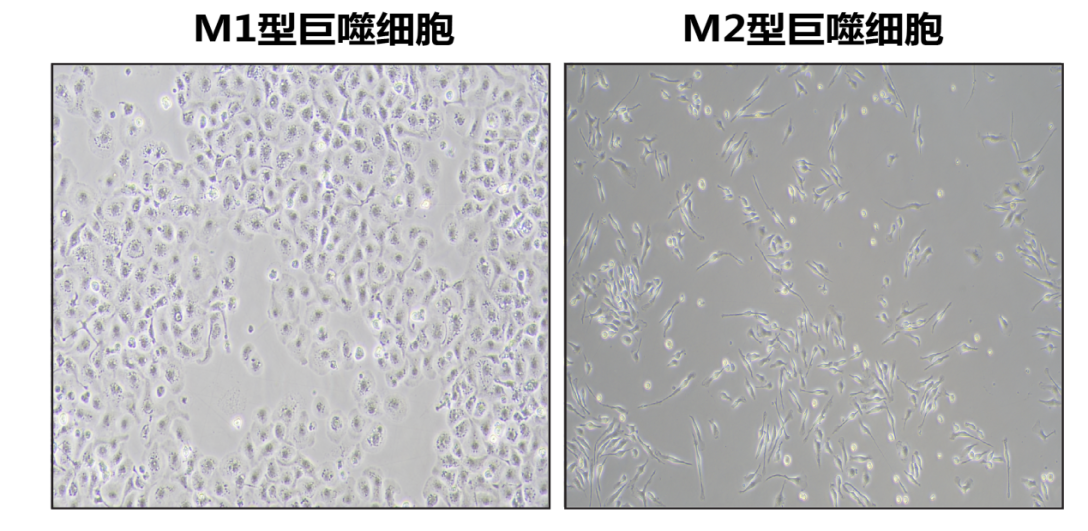
图4. C57小鼠骨髓细胞极化M1和M2形态对比。由图可见,M1巨噬细胞偏圆形,伪足较少且细胞质颗粒感明显,M2巨噬细胞呈长梭形、纤维细胞样。
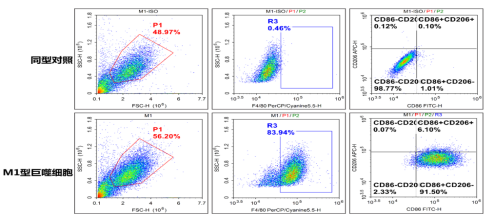
图5. C57小鼠骨髓细胞极化M1后使用FITC-CD86(E-AB-F0994C)/APC-CD206(E-AB-F1135E)/PerCP/Cyanine5.5-F4/80(E-AB-F0995J)检测并分析结果。由图可见,和同型组相比,极化后M1巨噬细胞高表达F4/80和CD86。
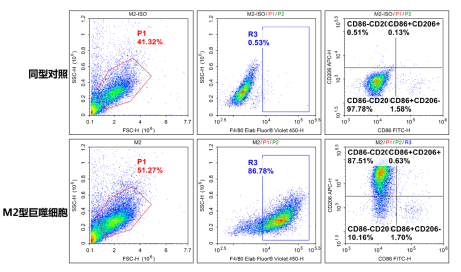
图6. BMDM极化M2使用FITC-CD86(E-AB-F0994C)/APC-CD206(E-AB-F1135E)/PerCP/Cyanine5.5-F4/80(E-AB-F0995J)检测并分析结果。由图可见,和同型组相比,极化后M2巨噬细胞高表达F4/80和CD206。
3、THP-1极化M1和M2型巨噬细胞检测结果
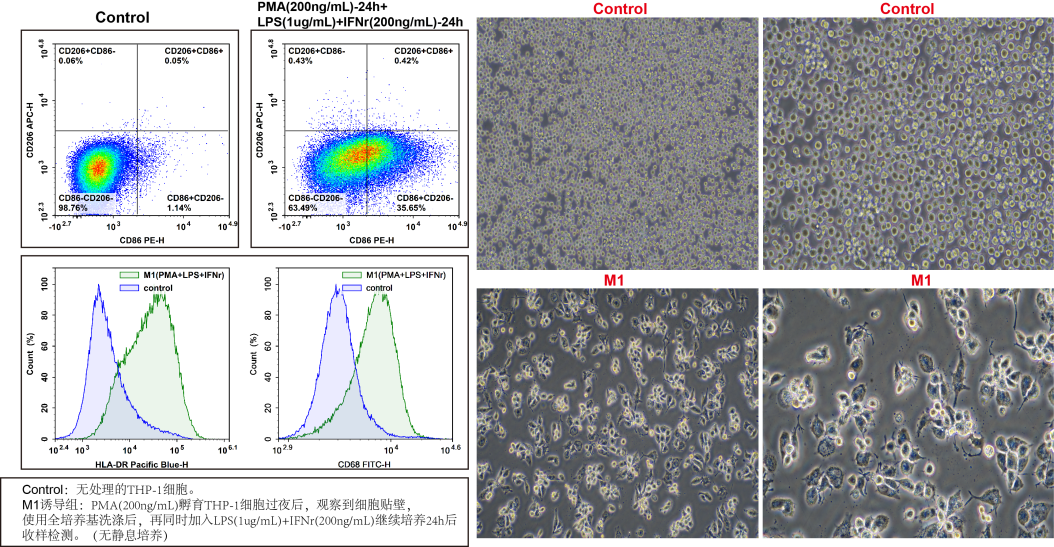
图7. THP-1极化M1后使用PE-CD86(E-AB-F1012D)/APC-CD206(E-AB-F1161E)/Elab Fluor® Violet 450-HLA-DR(E-AB-F1111Q)/Elab Fluor® 488-CD68(E-AB-F1299L)/PerCP/Cyanine5.5-CD163(E-AB-F1298J)检测并分析结果。由图可见,M1细胞伪足少且短,细胞质颗粒感明显,和无处理的Control组细胞相比高表达HLA-DR/CD86/CD68,低表达CD206。
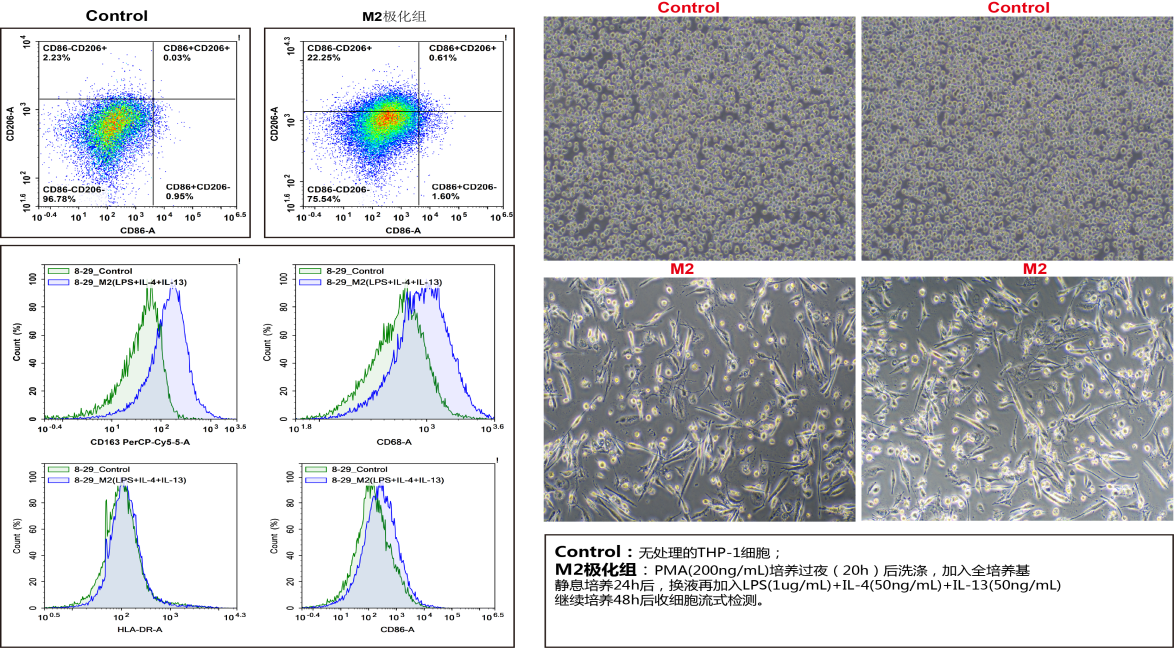
图8. THP-1极化M2后使用PE-CD86(E-AB-F1012D)/APC-CD206(E-AB-F1161E)/Elab Fluor® Violet 450-HLA-DR(E-AB-F1111Q)/Elab Fluor® 488-CD68(E-AB-F1299L)/PerCP/Cyanine5.5-CD163(E-AB-F1298J)检测并分析结果。由图可见,M2巨噬细胞呈长梭形、纤维细胞样,形状不规则,和无处理的Control组细胞相比高表达CD206和CD163,低表达HLA-DR和CD86。
三、注意事项
(1)THP-1细胞极化M2中PMA避免浓度太高导致细胞发生凋亡,建议使用低浓度(20-200 ng/mL)诱导为M0后,使用全培养基润洗2-3次,充分洗涤干净PMA后,加入全培养基静息培养过夜,再加入LPS和细胞因子进行极化效果最佳(有文献表明PMA后的静息培养有利于CD206的表达),极化过程密切关注细胞的形态变化,避免M2诱导时间过长,生长环境pH变化,细胞会转化为M1型(若需较长时间培养,建议按时更换含激活因子的培养基)。
(2)细胞培养过程,务必保证细胞良好的状态,稳定传代后再进行极化的诱导,容易事半功倍,模型成功率高。
(3)细胞收集过程,使用0.25%胰酶时间要适当,建议消化30 s-1 min后镜下观察,细胞突起有变短,即可使用1 mL移液器轻轻吹打细胞,使细胞吹打脱落(消化1 min后细胞很容易吹打脱落),再立即加入血清或者含血清培养基终止消化即可获取最佳状态的细胞,胰酶消化过度会导致表面抗原的丢失。
(4)检测前需加入Fc受体封闭剂,Raw264.7可使用CD16/32抗体封闭。
(5)THP-1少量细胞贴壁属于正常情况,将细胞悬液重新接种到新的培养瓶/皿中即可。当贴壁细胞比例超过20%,说明细胞生长状态异常,需要排查细胞培养过程中可能出现的各种问题,建议更换血清品牌,并适量提高完全培养基中的血清比例(不超过20%),当细胞密度增加后,聚团现象将自发改善。(血清使用前建议高速离心,去除杂质,培养效果更佳)
四、相关产品
|
产品名称 |
货号 |
厂家 |
|
M1型Raw264.7巨噬细胞极化培养和检测试剂盒 |
Elabscience® |
|
|
Extracellular Acidification Rate (ECAR) Fluorometric Assay Kit |
Elabscience® |
|
|
Oxygen Consumption Rate (OCR) Fluorometric Assay Kit |
Elabscience® |
|
|
L-精氨酸(L-Arg)比色法测试盒 |
Elabscience® |
|
|
ATP Chemiluminescence Assay Kit |
Elabscience® |
|
|
Intracellular Fixation/Permeabilization Buffer Kit |
Elabscience® |
|
|
Foxp3/Transcription Factor Staining Kit |
Elabscience® |
|
|
10×ACK Lysis Buffer |
Elabscience® |
|
|
Cell Staining Buffer |
Elabscience® |
|
|
EasySort™ Mouse CD4+T Cell Isolation Kit |
Elabscience® |
|
|
EasySort™ Mouse CD8+T Cell Isolation Kit |
Elabscience® |
我们致力于为大家呈现精彩的实验成果,包括形态学观察、细胞内代谢途径分析以及细胞免疫特征的检测。敬请持续关注我们的推文,并欢迎大家与我们交流探讨!
参考文献:
[1] Peng, M., Li, N., Wang, H., Li, Y., Liu, H., Luo, Y., Lang, B., Zhang, W., Li, S., Tian, L., & Liu, B. (2025). Macrophages: Subtypes, Distribution, Polarization, Immunomodulatory Functions, and Therapeutics. MedComm, 6(8). DOI:10.1002/mco2.70304.
[2] Liu T , Huang T , Li J ,et al.Optimization of differentiation and transcriptomic profile of THP-1 cells into macrophage by PMA[J].PLoS ONE, 2023, 18(7).DOI:10.1371/journal.pone.0286056.
[3] Genin M , Clement F , Fattaccioli A ,et al.M1 and M2 macrophages derived from THP-1 cells differentially modulate the response of cancer cells to etoposide[J].BMC Cancer, 2015, 15.DOI:10.1186/s12885-015-1546-9.
[4] Jo H , Lee E Y , Cho H S ,et al.THP-1 Monocytic Cells Are Polarized to More Antitumorigenic Macrophages by Serial Treatment with Phorbol-12-Myristate-13-Acetate and PD98059[J].Medicina (1010660X), 2024, 60(6).DOI:10.3390/medicina60061009.
[5] Peton B , Valerio M , Taniguchi M ,et al.The Impact of Hypomethylating Agents and BCL-2 Inhibitor on HLA Expression on THP-1 Cells[J].Blood, 2021, 138(Sup1):3990.DOI:10.1182/blood-2021-145801.
往期回顾:






