细胞代谢 | 能量代谢与免疫细胞:揭秘T细胞和巨噬细胞的能量代谢
Source: Elabscience®Published: 2025-02-28
能量代谢是生命最基本的特征之一,为细胞的各种生命活动提供能量,涉及糖酵解(Glycolysis)、脂肪酸β氧化(FAO)、三羧酸(TCA)循环及氧化磷酸化(OXPHOS)等代谢途径。能量代谢检测在诸多研究领域有着广泛应用,包括线粒体、代谢疾病及症代谢等方面。
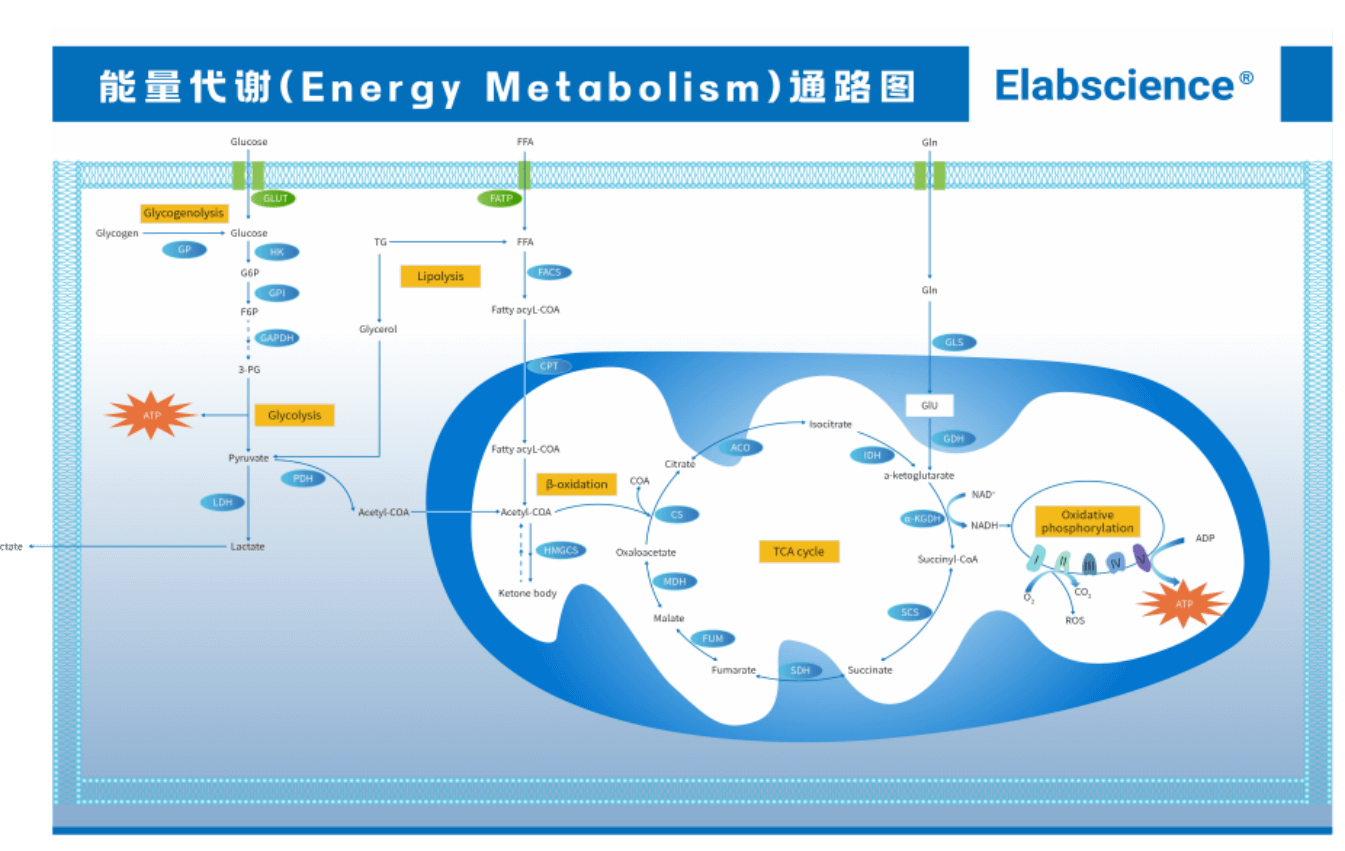
图1. 能量代谢通路图
研究表明,免疫细胞的功能与其能量代谢状态密切相关。今天,我们将聚焦于两种“明星”免疫细胞——T细胞和巨噬细胞,看看它们的能量代谢如何影响它们的“战斗力”。
巨噬细胞的能量代谢
巨噬细胞作为机体关键的固有免疫细胞,通过强大的吞噬作用支持免疫防御、自稳及监视。它们活跃于肿瘤、心血管疾病、感染及炎症等多种病症中。根据微环境的不同,巨噬细胞可以极化为M1型或M2型,分别发挥促炎和抗炎作用,具有不同的代谢特征[1]。
研究发现,M1巨噬细胞通过iNOS表达,利用精氨酸生成NO,其代谢特征表现为糖酵解增强、脂肪酸合成增加,同时TCA循环和OXPHOS功能受损。具体而言,M1巨噬细胞的TCA循环在异柠檬酸脱氢酶催化步骤和琥珀酸生成后出现两个关键偏离点,导致细胞内柠檬酸盐和琥珀酸盐浓度显著升高[2]。OXPHOS障碍引发电子传递链泄漏,在有氧环境中产生大量活性氧(ROS)以杀伤病原体。
相反,M2巨噬细胞利用精氨酸酶1(Arg-1)途径将精氨酸转化为鸟氨酸和尿素,特点是增强的OXPHOS、脂肪酸合成和谷氨酰胺代谢。研究表明,谷氨酰胺代谢通过多重机制驱动M2极化,且谷氨酰胺合成酶(GS)在M2中高表达,而M1中几乎无表达[3]。
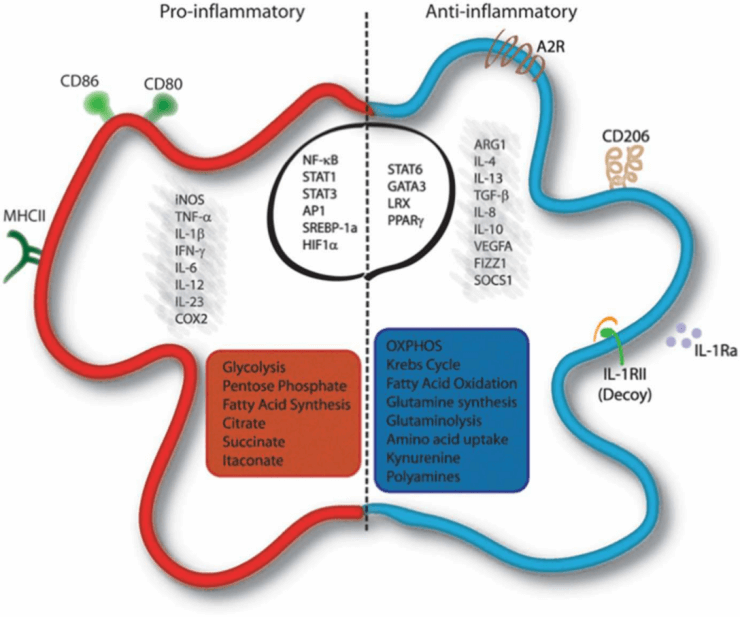
图2. 巨噬细胞活化的分子和代谢特征[2]
T细胞的能量代谢
T细胞是适应性免疫系统的核心组成部分,负责识别并清除病原体感染的细胞以及癌细胞。它们的功能高度依赖能量代谢,从静息状态到激活状态,再到分化成不同亚型,T细胞的代谢模式会发生显著变化[4]。
静息状态下的T细胞依赖OXPHOS通过线粒体电子传递链稳定生成ATP[5]。抗原呈递细胞(APC)激活T细胞后,其代谢模式迅速从OXPHOS转向糖酵解,以快速产生大量ATP,支持细胞增殖和分化[6]。活化后的T细胞分化为效应T细胞(如Th1、Th2、Th17等)或调节性T细胞(Treg),其中效应T细胞以高糖酵解活性为特征,而Treg主要依赖FAO[7]。记忆T细胞则平衡了糖酵解与OXPHOS,使其既能在需要时快速反应,又能在无刺激时持久存活[8]。
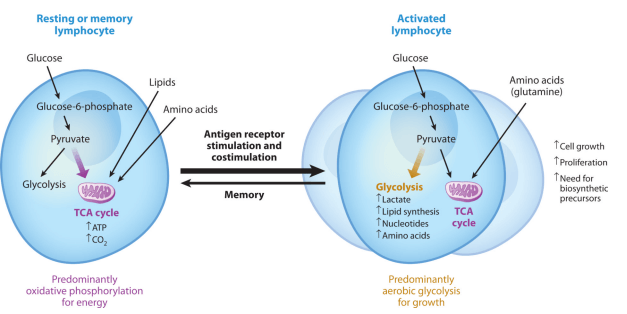
图3. T细胞活化的分子和代谢特征[6]
能量代谢不仅支持免疫细胞生存,还调控其功能与命运。在巨噬细胞中,糖酵解与OXPHOS的平衡决定促炎特性:代谢从TCA循环和FAO转向糖酵解和脂肪酸合成时,促炎性增强。T细胞中,有氧糖酵解和谷氨酰胺分解促进Th1和Th17分化,而抑制乳酸生成、增强OXPHOS或提高脂肪酸摄取能调节此过程。反之,抑制糖酵解或谷氨酰胺利用则有利于Treg分化[9]。此外,PD-L1/PD-1和CTLA-4等免疫检查点分子不仅调控T细胞活性,还影响其代谢状态。阻断这些检查点可逆转T细胞耗竭,恢复其抗肿瘤功能[10]。
综上,能量代谢是免疫细胞功能的基础与调控关键。免疫细胞能够感知外部环境变化,启动相应的免疫反应。在需要大量代谢物进行生物合成和分泌时,例如M1巨噬细胞和活化的T细胞,优先选择有氧糖酵解。相比之下,M2巨噬细胞和Treg细胞因需求较低,主要依赖OXPHOS和FAO。研究T细胞和巨噬细胞的代谢机制,有望为癌症、感染和自身免疫疾病等提供新的治疗思路。
Elabscience®助力免疫细胞代谢研究
想深入研究免疫细胞的能量代谢?Elabscience®提供全系列能量代谢检测试剂盒,助你轻松解锁免疫细胞的代谢密码!
货号 | 产品名称 |
氧消耗率(OCR)荧光法测试盒 | |
细胞外酸化率荧光法测试盒 | |
糖酵解压力荧光法测试盒 | |
脂肪酸氧化(FAO)比色法测试盒 | |
谷氨酰胺(Gln)比色法测试盒 | |
琥珀酸比色法测试盒 |
了解更多能量代谢产品信息,请访问细胞代谢检测试剂盒栏目或在线咨询我们。
能量代谢不仅是免疫细胞的“能量密码”,更是它们功能与命运的关键调控者。通过对T细胞和巨噬细胞代谢机制的深入研究,有望为多种疾病的治疗带来新的希望!快来和Elabscience®一起,探索免疫细胞的能量奥秘吧!
参考文献
1.Martinez FO, Gordon S. The M1 and M2 paradigm of macrophage activation: time for reassessment. F1000Prime Rep. 2014.
2. Liu Y, Xu R, Gu H, et al. Metabolic reprogramming in macrophage responses. Biomark Res. 2021.
3. Palmieri EM, Menga A, Martín-Pérez R, et al. Pharmacologic or Genetic Targeting of Glutamine Synthetase Skews Macrophages toward an M1-like Phenotype and Inhibits Tumor Metastasis. Cell Rep. 2017.
4. Artyomov MN, Van den Bossche J. Immunometabolism in the Single-Cell Era. Cell Metab. 2020.
5. Buck MD, O'Sullivan D, Klein Geltink RI, et al. Mitochondrial Dynamics Controls T Cell Fate through Metabolic Programming. Cell. 2016.
6. MacIver NJ, Michalek RD, Rathmell JC. Metabolic regulation of T lymphocytes. Annu Rev Immunol. 2013.
7. Chang CH, Qiu J, O'Sullivan D, et al. Metabolic Competition in the Tumor Microenvironment Is a Driver of Cancer Progression. Cell. 2015.
8. Pearce EL, Pearce EJ. Metabolic pathways in immune cell activation and quiescence. Immunity. 2013
9. Desdín-Micó G, Soto-Heredero G, Mittelbrunn M. Mitochondrial activity in T cells. Mitochondrion. 2018.
10. Peng W, Liu C, Xu C, et al. PD-1 blockade enhances T-cell migration to tumors by elevating IFN-γ inducible chemokines. Cancer Res. 2012.






