巨噬细胞分离&诱导指南:从取材到培养,详细步骤搞定全能“免疫玩家”!
Source: Elabscience®Published: 2025-09-02
巨噬细胞作为先天免疫的“核心玩家”,不仅能启动对病原体的免疫反应和炎症反应,更在组织修复与再生以及维持机体稳态中发挥核心作用。虽然巨噬细胞存在于大部分组织中,但细胞占比却极少,其分离与培养通常为单核细胞的富集与诱导为核心。本期小E带你一步步搞定人及小鼠巨噬细胞的分离方法,还有分离后巨噬细胞诱导分化的秘籍,让你实验顺利不发愁!
巨噬细胞的分离
一、人巨噬细胞分离方法
巨噬细胞是定居在各类组织中的终末分化细胞(如肝脏中的库普弗细胞、肺中的肺泡巨噬细胞等)。它们通常不会在血液中循环。当发生感染或炎症时,血液中的单核细胞才会被招募到组织中,并最终分化为巨噬细胞或树突状细胞来发挥作用。因此,直接从外周血中获取巨噬细胞是不可行的。现行的人巨噬细胞主要分离方法如下:
1.富集单核细胞(Monocyte Isolation):作为巨噬细胞的直接前体,单核细胞在PBMCs中占10-30%,可以通过阴性分选(可避免激活细胞)、阳性分选(抗CD14磁珠)或黏附法从PBMC中有效地分离和富集出来。这三种富集方法各有优劣:
-
阴性分选是通过除去样本中不需要的细胞,间接富集细胞。因此纯度较高细胞不会被激活,细胞状态较好对后续实验影响较小。
-
阳性分选是通过特异性抗体标记目标细胞进行分选,细胞分选纯度高。
-
黏附法是利用巨噬细胞容易贴壁的特性,将PBMC接种到培养皿中37℃培养3-4小时后,更换新鲜培养液以去除未贴壁细胞,即可获得较高纯度的贴壁单核细胞。该方法操作简单,成本较低。
2.体外诱导分化(In vitro Differentiation):将富集到的纯度高、状态好的单核细胞,在特定细胞因子(如M-CSF或GM-CSF)的刺激下,培养5-7天,使其成熟为形态和功能上都类似于体内巨噬细胞的衍生巨噬细胞b。
二、小鼠巨噬细胞分离方法
原代小鼠巨噬细胞可以从骨髓、腹腔、肺或脂肪组织等多个部位获得。目前巨噬细胞的分离方法主要为腹腔巨噬细胞提取和骨髓来源巨噬细胞提取。
1.小鼠腹腔巨噬细胞的提取
巨噬细胞天然存在于小鼠腹腔,且腹腔巨噬细胞多游离存在于腹水中易于获得。腹腔注射巯基乙酸肉汤后可招募血液中的单核细胞至腹腔并分化为巨噬细胞,从而显著扩增腹腔巨噬细胞的数量。
▪操作步骤如下:(1)连续三天向小鼠腹腔注射1 mL的3%巯基乙酸盐肉汤。(2)三天后,以脱颈方式处死小鼠,将小鼠四肢固定于泡沫板上,小心剪开外皮使腹膜暴露出来。(3)用注射器吸取5 ml预冷PBS注射进小鼠腹腔内。轻揉小鼠腹部,使液体在腹腔内充分流动。(4)用注射器回抽腹腔灌洗液,转移至离心管中。(5)重复清洗腹腔步骤3次,将收集的所有腹腔灌洗液以300g离心5分钟。(6)弃上清,用完全细胞培养基重悬细胞,计数后接种于培养板中。(7)37℃培养2-4小时后,更换新鲜培养液以去除未贴壁细胞,贴壁细胞即为巨噬细胞。
2.骨髓来源巨噬细胞提取
在原代巨噬细胞的获取过程中,直接分离的腹腔巨噬细胞(或者肺泡巨噬细胞)数量有限,在未经诱导时,每只小鼠只能获取1.5-3×106个腹腔巨噬细胞,因此骨髓诱导分化的巨噬细胞(Bone marrow-derived macrophages,BMDM)是目前实验室最常用的分离小鼠巨噬细胞的选择。
—操作步骤如下:
(1)处死小鼠后,将小鼠置于75%乙醇中浸泡5 min进行灭菌消毒。
(2)完整取出其双侧股骨和胫骨,剔除骨上附着的肌肉和组织。
(3)将清洗好的股骨、胫骨分开,并用剪刀分别将股骨、胫骨两端剪断,使用25G注射器吸取预冷的诱导培养基将骨髓从股骨、胫骨中吹出,反复吹洗3次,直至骨内看不到明显的红色为止。
(4)反复吹打,将块状的细胞团吹散。
(5)然后使用70 μm细胞滤器将细胞过筛,转移至15 mL离心管中,300×g离心5 min,弃上清。
(6)加入红细胞裂解液重悬,混悬细胞沉淀,室温静置2 min后,加入10 mL PBS进行洗涤。
(7)300×g离心5 min,弃上清,用配置好的骨髓巨噬细胞诱导培养基重悬,铺板培养。细胞培养期间,每隔2-3天更换新鲜骨髓来源巨噬细胞培养基,加入培养基前用PBS清洗细胞,培养7天后收集细胞。
3.巨噬细胞的诱导
上述过程收集到的细胞大部分为M0期巨噬细胞。在不同微环境下巨噬细胞会表现出不同的活化状态和功能,它们可以分为M1型(经典活化巨噬细胞)和M2型(替代活化巨噬细胞)。M1巨噬细胞的作用是分泌促炎性细胞因子和趋化因子,呈递抗原,从而参与积极的免疫应答,作为免疫监视的功能。它产生的主要促炎细胞因子是IL-6、IL-12和TNF-α。M2巨噬细胞主要分泌Arginase-I、IL-10和TGF-0等抗炎细胞因子,具有减少炎症和促进肿瘤生长及免疫抑制功能,同时也在伤口愈合和组织修复中发挥重要作用。
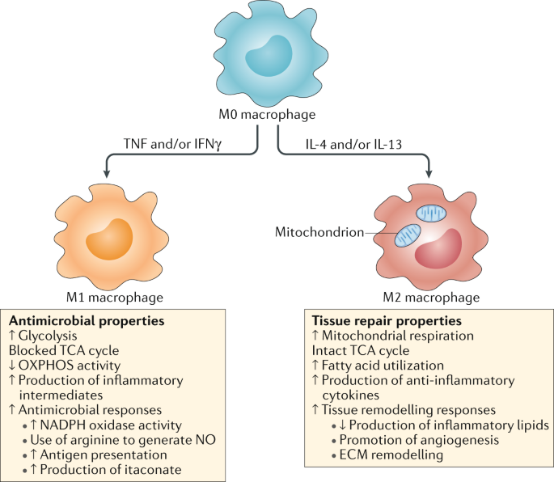
图1. M0型巨噬细胞的诱导分化
三、巨噬细胞诱导分化方法
1. 细胞因子选择
-
GM-CSF(粒细胞-巨噬细胞集落刺激因子)倾向于诱导产生类似于M1型(促炎型)的巨噬细胞,这些细胞具有更强的抗原提呈和产生促炎因子的能力,是研究炎症、免疫应答的常用模型。
-
M-CSF(巨噬细胞集落刺激因子)倾向于诱导产生类似于M2型(抑炎型)的巨噬细胞,这些细胞具有更强的吞噬和清除能力,是研究稳态、修复和肿瘤相关巨噬细胞(TAMs)的常用模型。
IFN-γ和LPS可以将巨噬细胞分化为促炎性的M1巨噬细胞。Th2细胞产生的IL-4和IL-13可以将巨噬细胞转化为抑制炎症的M2型巨噬细胞。
2. 培养基配置
巨噬细胞诱导分化过程使用完全培养基,例如:RPMI-1640+10% FBS(胎牛血清)+1%青霉素/链霉素(P/S)+上述细胞因子(M-CSF或GM-CSF)。
3. 培养步骤
(1)将分选得到的单核细胞用预冷的完全培养基重悬计数,以适当的密度接种到细胞培养皿中,在37°C, 5% CO₂的培养箱中培养。(2)每3天换含有相同浓度细胞因子的完全培养基,培养5-7天后,细胞形态从初始的圆形、半悬浮或弱贴壁状态,逐渐分化为体积增大、完全贴壁、形态不规则的M0巨噬细胞。(3)可根据实验需求,再用不同的细胞因子刺激24-48 h使其极化为特定表型。
-
M1型极化:使用IFN-γ(20 ng/mL)+LPS(100 ng/mL)刺激。
-
M2型极化:使用IL-4(20 ng/mL)+IL-13(20 ng/mL)刺激。
本期巨噬细胞的分离及诱导方法就介绍到这里啦,各位老师有任何建议或疑问欢迎留言探讨。后续我们将陆续推出以下内容:组织驻留巨噬细胞检测宝典、巨噬细胞代谢研究攻略以及巨噬细胞M1/M2定向极化秘籍和检测方案。
更多硬核干货,持续锁定Elabscience®推文,也欢迎在评论区和我们交流你的实验心得哦~
往期回顾:






