巨噬细胞研究热点及解决方案:组织驻留巨噬细胞高效检测宝典!
Source: Elabscience®Published: 2025-09-09
还在为组织驻留巨噬细胞的检测而困扰?不同组织、不同来源、不同功能亚群——如何精准区分与高效检测?今天小E给大家系统解析脾脏、骨髓、腹腔等组织中巨噬细胞的Marker选择、实验流程及关键注意事项,助你轻松搞定实验、获取可靠数据!
一、组织驻留巨噬细胞简介
组织驻留巨噬细胞并非全部来自血液中的单核细胞,根据其发育起源,可以分为两大类:一类在胚胎发育早期,由卵黄囊或胎儿肝脏中的前体细胞分化而来,在成年后,主要通过局部自我增殖来维持群体稳定,而不依赖于骨髓造血,如大脑中的小胶质细胞、肝脏组织中的Kupffer细胞、肺组织中的肺泡巨噬细胞、皮肤中的朗格汉斯细胞等;另一类由骨髓中的造血干细胞分化为单核细胞,进入血液循环,在炎症、感染或组织损伤后,被大量招募到病变区域,补充或替换原有的巨噬细胞群体,如感染后病变组织周围的浸润巨噬细胞。组织常驻巨噬细胞是一个混合群体,在稳态下以胚胎起源为主,在炎症、感染等动态变化中,骨髓来源的细胞会不断融入。检测不同组织中巨噬细胞的分类和比例,可以精确的反应组织器官的功能状态。不同组织中的巨噬细胞分类和功能如下表所示。
|
组织器官 |
细胞名称 |
流式检测常用Marker(Mouse) |
主要功能 |
|
心脏 |
CCR2-巨噬细胞(常驻), CCR2+巨噬细胞(招募) |
CCR2, CX3CR1, MHC-II、CD45、CD11b、CD11c、Ly6G、Ly6C |
清除废物、电传导、损伤修复 |
|
肝脏 |
Kupffer细胞 |
CD45、MHCII、CD11b、CD64、CD103、F4/80、CXCR1、TIM4、CD207 |
清除血源性病原体、红细胞清理 |
|
脾脏/淋巴结 |
红髓/边缘区巨噬细胞 |
Lineage(CD3ε、CD19、Ly6G、CD49b)、CD45、CD11b、CD64、F4/80 |
清除衰老红细胞、捕获血液中的抗原 |
|
肺部 |
肺泡巨噬细胞、肺间质巨噬细胞 |
CD45, CD11b, Siglec F、F4/80、CD11c |
维持肺泡表面活性物质稳态、免疫耐受 |
|
大脑 |
小胶质细胞 |
CD11b、CD45、P2RY12、CD11c、CD282、CLEC7A、CD317、CD63 |
免疫监视、突触修剪、清除 debris |
|
皮肤 |
朗格汉斯细胞 |
CD1a, Langerin (CD207) |
抗原呈递、皮肤免疫监视 |
|
骨组织 |
破骨细胞 |
CD51, CTR (降钙素受体) |
骨吸收(一种特殊功能的巨噬细胞) |
|
骨髓 |
骨髓巨噬细胞 |
Lineage(CD3ε、CD19、Ly6G、CD49b)、CD45、CD11b、CD64、F4/80、MerTK |
参与骨骼的形成、代谢、稳态维持和修复;调控炎症反应 |
|
肿瘤微环境 |
肿瘤相关巨噬细胞 |
CD45、CD11b、MHCII、F4/80、CD163、CD86、CD206、Arg1、IL-10、TGF-β、CCL2、CCL5、CD200R、iNOS |
促进肿瘤生长、血管生成、抑制T细胞功能 |
|
肠道 |
肠固有层巨噬细胞等 |
Lineage(CD3ε、CD19、Ly6G、CD49b/NK1.1)、CD45、CD11b、CD64、CD11c、MHCII、Ly6C |
维持对无害抗原的耐受、清除病原体和有害物质 |
|
腹腔 |
腹腔巨噬细胞 |
CD45、CD11b、F4/80、CD86、CD206 |
免疫防御、炎症反应和组织修复 |
二、组织驻留巨噬细胞检测结果分析
(1)脾脏巨噬细胞检测结果
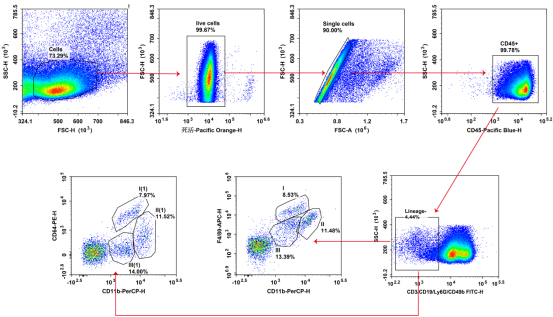
图1. Balb/c小鼠脾脏细胞,使用Mouse CD45(E-AB-F1136Q)、CD11b(E-AB-F1081J)、F4/80(E-AB-F0995E)、CD64(E-AB-F1186D)、FITC-Lineage(CD3(E-AB-F1013C)、CD19(E-AB-F0986C)、Ly6G(E-AB-F1108C)、CD49b(E-AB-F1116C))流式抗体染色并分析结果。
I. 巨噬细胞:CD11bmidF4/80hi巨噬细胞或CD11bmidCD64hi巨噬细胞,多为活化的炎症型巨噬细胞,以“强效抗感染和免疫清除”为核心。
II. 巨噬细胞:CD11bhiF4/80mid/hi巨噬细胞或CD11bhiCD64mid巨噬细胞,多为急性感染期红髓区和白髓区活化的巨噬细胞,用于评估脾脏稳态应激状态与早期免疫异常。
III. 巨噬细胞:CD11blowF4/80low巨噬细胞或CD11blowCD64-/low巨噬细胞,多为定居于脾脏边缘区,白髓与红髓交界处的巨噬细胞(Marginal Zone Macrophage, MZM)以及静息态红髓定居巨噬细胞,是血液抗原进入脾脏的“第一道免疫屏障”。
(2)骨髓巨噬细胞检测结果
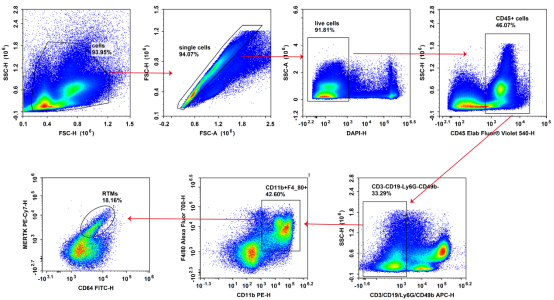
图2. Balb/c小鼠骨髓细胞使用Mouse CD45(E-AB-F1137T3)、CD11b(E-AB-F1081D)、F4/80(E-AB-F0995M1)、CD64(E-AB-F1186C)、APC-Lineage(CD3(E-AB-F1013E)、CD19(E-AB-F0986E)、Ly6G(E-AB-F1108E)、CD49b(E-AB-F1116E))、DAPI(E-CK-A163)、MerTK系列抗体(火热上线中,详询)流式抗体染色并分析结果检测结果。
数据分析流程:圈出DAPI-的活细胞群,进一步圈出CD45+的白细胞群,再分析圈出lineage-(CD3/CD19/Ly6G/CD49b)细胞群(排除掉T细胞/B细胞/粒细胞/NK细胞),进一步圈出CD11b和F4/80双阳性细胞后分析CD64+和MerTK+细胞群,该细胞群为骨髓中的骨髓驻留型功能巨噬细胞,主要发挥造血支持和骨髓稳态的作用。
(3)腹水巨噬细胞检测结果
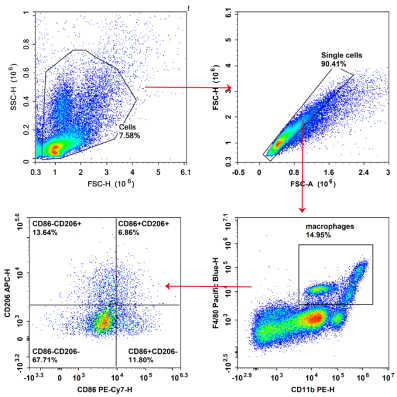
图3. C57腹腔炎症小鼠取腹水样本,使用Mouse CD11b(E-AB-F1081D)、F4/80(E-AB-F0995Q)、CD86(E-AB-F0994H)、CD206(E-AB-F1135E)染色并使用流式细胞仪检测分析巨噬细胞的功能分型。小鼠腹水巨噬细胞为CD11bhi/midF4/80hi/mid巨噬细胞,是炎性活化的巨噬细胞,进一步分析该细胞群中CD206和CD86的表达,不同的细胞比例和分群代表巨噬细胞的不同功能状态。
三、组织驻留巨噬细胞的检测流程和注意事项
(1)脾脏巨噬细胞检测方案
①脾脏单细胞悬液的制备:取新鲜的小鼠脾脏样本,研磨法或者使用1 mL注射器吹打等方法制备成单细胞悬液,300×g离心3-5 min,弃上清。加入2 mL的1×ACK Lysis Buffer(E-CK-A105)重悬细胞,轻轻吹打混匀,室温静置2 min裂解红细胞。(注:裂解时间不超过2 min,防止裂解过度;室温过高超过25℃时,为保持细胞状态,建议4℃裂解);裂解完成后,立即加入12 mL PBS缓冲液或RPMI-1640基础培养基吹打混匀终止裂解,300×g离心3-5 min,弃上清。
②脾脏巨噬细胞的流式检测:使用Cell Staining Buffer重悬细胞,细胞计数,并调整细胞密度至1×106/mL。取100 μL细胞悬液加入CD16/32封闭抗体,轻轻吹打混匀,4℃封闭孵育10-20 min。再分别加入流式待测抗体,轻轻吹打混匀,继续4℃避光孵育30 min。加入1-2 mL的Cell Staining Buffer重悬细胞,轻轻吹打后150-300×g离心3-5 min,弃上清。加入100-300 μL的Cell Staining Buffer重悬细胞,上机检测。
(2)骨髓巨噬细胞检测方案
①骨髓单细胞悬液的制备:对小鼠实施安乐死,用70%乙醇浸泡3-5 min。在超净工作台中,将小鼠置于10 cm培养皿中,用剪刀去除皮肤,露出小腿,剪掉靠近下肢根部的主要肌肉,露出髋关节。切开股骨底部附近,切断跟腱,移除股骨周围的主要肌肉。在膝关节处切割,去除胫骨周围的主要肌肉,去除腓骨。去掉股骨和胫骨的骨痂,转移到新的6 cm细胞培养皿中,用1 mL注射器吸取1640全培养基(1640基础+10%FBS+1%P/S+1%L-丙氨酰-L-谷氨酰胺(100×)),插入骨髓腔,轻轻吹打出骨髓细胞,重复步骤至骨髓细胞完全吹出。用滤网将细胞过滤到15 mL的离心管中,150-300×g离心3-5 min,弃上清。加入1 mL 1×ACK Lysis Buffer(注:1×红细胞裂解液建议4℃预冷,用前取出,严格把控裂红时间,避免裂红过度导致细胞损失),轻轻吹打混匀,室温裂红静置30 s,立即加入10 mL PBS轻轻吹打混匀细胞,终止裂解。150-300×g离心3-5 min,弃上清,即为小鼠骨髓细胞。
②骨髓单细胞悬液的流式检测:使用Cell Staining Buffer重悬细胞计数,调整细胞密度至1×106/mL。取100 μL细胞悬液,加入CD16/32封闭抗体,轻轻吹打混匀,4℃封闭孵育10-20 min。再加入流式待测抗体,轻轻吹打混匀,继续4℃避光孵育30 min。加入1-2 mL的Cell Staining Buffer重悬细胞,轻轻吹打后150-300×g离心3-5 min,弃上清。再加入100-300 μL的Cell Staining Buffer重悬细胞,上机检测。
(3)腹腔巨噬细胞的制备及检测方案
①腹腔注射预备工作:使用巯基乙酸盐培养基配成3%的巯基乙酸盐肉汤,煮沸溶解。在121℃, 15-20 min高压灭菌后分装4℃保存。注射前,取出1支1 mL的3%巯基乙酸盐肉汤,用电磁炉沸水煮6 min,静置恢复室温。
②腹腔注射:左手抓小鼠,右手持注射器,缓慢以45°角扎进小鼠后肢根部连线处任一侧1.5 cm处,进针时感受到局部皮肤凹陷消失和落空感,深度不超过1 cm。轻轻挑动针头,避免扎进肠子,慢慢注射肉汤,完成后将小鼠放回鼠笼。每隔24 h注射1次肉汤,诱导72 h即可开始取小鼠腹水。
③腹水提取和检测:准备15 mL PBS(1×),4℃冰箱预冷15 min,颈椎脱臼处死小鼠。将小鼠腹部朝上,四肢固定在泡沫塑料板上,并用75%的酒精喷洗消毒。用镊子和剪刀剥离小鼠腹部表皮,暴露出腹膜,注意避免腹膜破裂。用5 mL注射器吸取5 mL PBS(1×),然后用镊子轻轻夹起中间腹膜,扎入注射器,尽量避免扎到组织脏器,然后缓慢注入PBS。手指轻轻按摩小鼠腹部约1-2 min,使PBS在腹腔中充分混匀,再用2.5 mL注射器沿着小鼠腹部侧面扎入,避免扎到内脏导致内出血。缓缓的抽取腹腔中的PBS,将PBS收集到15 mL的离心管中。重复操作,直到将预冷的15 mL PBS冲洗完为止。
④细胞保存:将收集好的腹水用离心机300×g离心3-5 min,离心完后去上清,留下白色沉淀。加入1-2 mL的Cell Staining Buffer重悬,放入4℃保存(或细胞计数后加入流式抗体进行检测分析或进一步进行细胞培养)。注:若需要后续持续培养的细胞,建议巨噬细胞提取过程使用无菌PBS,并在超净工作台操作。
⑤细胞培养及流式检测:在无菌环境下提取的腹水巨噬细胞使用1640全培养基重悬,调整细胞密度至5×105/mL,加入1 μg/mL的LPS诱导24 h。收集细胞,300×g离心3-5 min,离心后去上清。加入Cell Staining Buffer重悬白色沉淀,调整细胞密度至1×106/mL。取100 μL细胞悬液,加入CD16/32封闭抗体,轻轻吹打混匀,4℃封闭孵育10-20 min。再加入流式待测抗体,轻轻吹打混匀,继续4℃避光孵育30 min。加入1-2 mL的Cell Staining Buffer重悬细胞,轻轻吹打后150-300×g离心3-5 min,弃上清。加入100-300 μL的Cell Staining Buffer重悬细胞,上机检测。
四、相关产品
| 应用 | 产品名称 | 货号 |
| 巨噬细胞细胞因子分泌功能检测 | FITC 标记抗人IL-1β抗体[CRM56] | AN00842C |
| APC 标记抗小鼠IL-6抗体[MP5-20F3] | E-AB-F1207E | |
| FITC 标记抗小鼠IL-10抗体[JES5-16E3] | E-AB-F1197C | |
| PE/Cyanine7 标记抗小鼠TNFα抗体[XT3.11] | AN00567H | |
| 高灵敏度小鼠IL-1β(白细胞介素1β)ELISA 试剂盒 | E-HSEL-M0001 | |
| 人IL-18(白细胞介素18)ELISA 试剂盒 | E-EL-H0253 | |
| TGF-β1(转化生长因子β1)ELISA 试剂盒 | E-EL-0162 | |
| 巨噬细胞代谢功能检测 | 小鼠NOS2/iNOS(诱导型一氧化氮合酶2)ELISA 试剂盒 | E-EL-M0696 |
| 人NOS2/iNOS(诱导型一氧化氮合酶2)ELISA 试剂盒 | E-EL-H0753 | |
| 大鼠NOS2/iNOS(诱导型一氧化氮合酶2)ELISA 试剂盒 | E-EL-R0520 | |
| L-精氨酸(L-Arg)比色法检测试剂盒 | E-BC-K850-M | |
| 人ARG1(精氨酸酶1)ELISA 试剂盒 | E-EL-H0497 |
我们致力于为大家呈现精彩的实验成果,包括形态学观察、细胞内代谢途径分析以及细胞免疫特征的检测。后续将进一步推出Raw264.7和THP-1巨噬细胞M1/M2定向极化秘籍和检测方案及巨噬细胞代谢研究攻略。敬请持续关注我们的推文,并欢迎大家与我们交流探讨!更多的流式配色需求和分析需求请联系我们的技术团队!
参考文献:
[1] Zhao J, Andreev I, Silva H M .Resident tissue macrophages: Key coordinators of tissue homeostasis beyond immunity[J].Science Immunology, 2024, 9(94).DOI:10.1126/sciimmunol.add1967.
[2] Fujiyama S, Nakahashi-Oda C, Abe F, et al.Identification and isolation of splenic tissue-resident macrophage sub-populations by flow cytometry[J].International immunology, 2019, 31(1):51-56.DOI:10.1093/intimm/dxy064.
[3] Lazarov T, Juarez-Carreo S, Cox N, et al.Publisher Correction: Physiology and diseases of tissue-resident macrophages[J].Nature, 2023, 619(7970):E51-E51.DOI:10.1038/s41586-023-06386-w.
[4] Kaur S , Raggatt L J , Batoon L ,et al.Role of bone marrow macrophages in controlling homeostasis and repair in bone and bone marrow niches[J].Seminars in Cell & Developmental Biology, 2016:12.DOI:10.1016/j.semcdb.2016.08.009.
[5] Gupta S , Sarangi P P .Inflammation driven metabolic regulation and adaptation in macrophages[J].Clinical immunology: The official journal of the Clinical Immunology Society, 2023:246.DOI:10.1016/j.clim.2022.109216.
往期回顾:






