流式课堂 | 免疫系统的"特种兵":效应CD8+T细胞
Source: Elabscience®Published: 2025-05-27
在免疫系统的复杂网络中,效应CD8+ T细胞犹如训练有素的特种兵,精准识别并清除被病毒感染的细胞和肿瘤细胞,是宿主防御机制中的关键力量。今天Elabscience将介绍效应CD8+ T细胞的分型检测方法,助力科研人员深入探究免疫反应的机制!
一、背景介绍
作为T细胞的一个主要亚群,细胞毒性T细胞(CD8+ T细胞)在宿主防御病毒感染和清除肿瘤细胞等免疫反应进程中发挥重要作用。在免疫反应中,初始CD8+ T细胞能够特异性识别抗原提呈细胞(如DC细胞)表面的MHC I-抗原肽类复合物并被激活。进而分化为效应CD8+ T细胞。效应CD8+ T细胞具有较强的细胞毒性并分泌多种细胞因子。根据分泌细胞因子的不同、细胞毒性的强弱以及功能的不同,效应CD8+ T细胞可细分为不同的效应亚型,其中主要的三类效应亚型为:
Tc1细胞(Type 1 Cytotoxic T Cells):主要分泌分泌IFN-γ、TNF-α等细胞因子,关键转录因子为T-bet,通过IFN-γ激活巨噬细胞,增强其对胞内细菌(如结核分枝杆菌)和病毒的清除能力。可促进Th1型免疫反应,是抗肿瘤免疫的核心效应细胞。
Tc2细胞(Type 2 Cytotoxic T Cells):主要分泌IL-4、IL-5、IL-13等细胞因子,IL-4/IL-13可激活嗜酸性粒细胞和肥大细胞,帮助清除蠕虫等寄生虫。
Tc17 (Type 17 Cytotoxic T Cells):主要分泌IL-17A、IL-17F、IL-22等细胞因子,IL-17促进中性粒细胞募集,对抗白色念珠菌、金黄色葡萄球菌等。过度活化的Tc17可促进类风湿关节炎、多发性硬化等自身免疫疾病。
那么在研究中,我们如何构建TC1/TC2/TC17细胞模型并对这些效应亚型进行鉴定呢?在此,小E老师为大家提供TC1/TC2/TC17效应亚型的体外诱导及鉴定方案。
二、实验方案
A. 样本处理:
1) 将小鼠断脊椎处死后浸泡在酒精中,拿至细胞房进行样本处理。制备单细胞悬液:在70 μm细胞筛网(底部可以稍微悬空)上研磨小鼠脾脏,以预冷的PBS冲洗细胞筛网,收集细胞悬液于15 mL离心管中,300×g,离心5 min。
2) 用1 mL 分选buffer将脾脏细胞重悬,细胞悬液用70 μm细胞筛网过滤于2 mL EP管,稀释后计数,调整细胞密度为2×108 cells/mL。
B. 初始 CD8+T细胞分选实验步骤:
1) 取1 mL细胞悬液,加入10 μL的FC封闭抗体和10 μL抗体混合物。室温孵育10 min。加入磁珠100 μL,室温孵育5 min。加入分选buffer到2.5 mL。
2) 使用磁力架进行磁吸2.5 min。拿起磁极,以一个连续的动作翻转磁极和试管,倾倒富集的细胞悬液至一个新的试管中。计数离心后使用PBMC培养基重悬。
C. 初始 CD8+T细胞分选后流式检测实验步骤:
3) 对未分选细胞悬液以及分选后上清细胞悬液进行染色。取100 μL样品,每管加入CD8/CD62L/CD44/CD3抗体各5 μL,4℃孵育30 min。
4) 加1 mLPBS,混匀,300×g离心5 min,去上清,加200 μL PBS重悬,直接上机检测。
D. 上机操作:停止条件设置为采集90 μL细胞悬液,阈值FSC-H大于4000,分析阳性T+细胞群比例即为分选纯度。
E. 活化诱导效应CD8+T细胞:
1) 用完全培养基(自备)将样本制备成单细胞悬液,并调整细胞密度为 1-2×10 6 /mL。 注:细胞密度不可过高,最大密度不超过 2×10 6个/mL,细胞密度过高会影响细胞的激活效率;关注细胞状态,对于新鲜制备的原代细胞,先观察确认细胞状态良好后再诱导检测。
2) 加入对应的单抗和蛋白进行刺激诱导72 h。
实验分组 | 诱导方案 |
Tc1/Tc17 | 加入CD3/CD28磁珠活化IL-6(50 ng/ml) IL-2(8 ng/ml) TGF-β(3 µg/mL) |
Tc2 | 加入CD3/CD28磁珠活化IL-4(20 ng/ml) IL-2(8 ng/ml) anti-IFN-γ(5 µg/mL) |
Control | 加入CD3/CD28磁珠活化 |
A. Tc1/Tc2/Tc17细胞检测方案:
1) 每1 mL 细胞悬液中,加入 2 μL 的 500×Cell Stimulation MIX,于37°C、5%CO2培养箱中孵育细胞0.5-1 h;
2) 每1 mL 细胞悬液中,加入1 μL 1000×Protein Transport Inhibitor MIX,于 37°C、5%CO2培养箱中继续孵育5-6 h。
3) 收集细胞,300×g离心5 min,弃去上清液。每组加180 μL PBS重悬细胞,按照Fixation Buffer:样本=1:3的比例加入60 μL Fixation Buffer,轻轻吹打混匀,4°C静置过夜固定或室温固定1小时。
4) 固定后的细胞会沉降至EP管底部,不用离心,小心吸弃部分上清(避免吸到细胞),加入1-2 mL 1× Permeabilization Buffer,轻轻吹打混匀,500×g离心5 min,弃上清。注:液体尽量吸弃干净,不要有残留,吸弃上清时不要吸到细胞沉淀。
5) 各组加入100 μL 1× Permeabilization Buffer重悬细胞沉淀,每组直接加入对应抗体,室温避光孵育60 min(每15-20min混匀一次)。
6) 孵育完成后,各组加入1-2 mL PBS,轻轻吹打混匀,500×g离心5 min,弃上清。
7) 各组加入100-200 μL PBS重悬细胞沉淀,流式上机检测。
B. 上机操作:停止条件设置为采集90 μL细胞悬液,阈值FSC-H大于4000,分析Tc1(CD3+CD8+IFN-γ+)、Tc2(CD3+CD8+IL-4+)、Tc17
(CD3+CD8+IL-17A+)细胞群比例。
染色方案如下:
方案分类 | 指标 | 荧光标记 | 克隆号 | 货号 |
初始CD8+ T细胞纯度鉴定方案 | APC | 17A2 | E-AB-F1013E | |
Elab Fluor® Violet 450 | 53-6.7 | E-AB-F1104Q | ||
Elab Fluor® 488 | IM7 | E-AB-F1100L | ||
PE | MEL-14 | E-AB-F1011D | ||
Tc1/Tc2/Tc17效应亚型鉴定方案 | APC | 17A2 | E-AB-F1013E | |
Elab Fluor® Violet 450 | 53-6.7 | E-AB-F1104Q | ||
PE | XMG1.2 | E-AB-F1101D | ||
APC | 11B11 | E-AB-F1204E | ||
PE/Cyanine7 | 17F3 | E-AB-F1272H |
三、结果展示
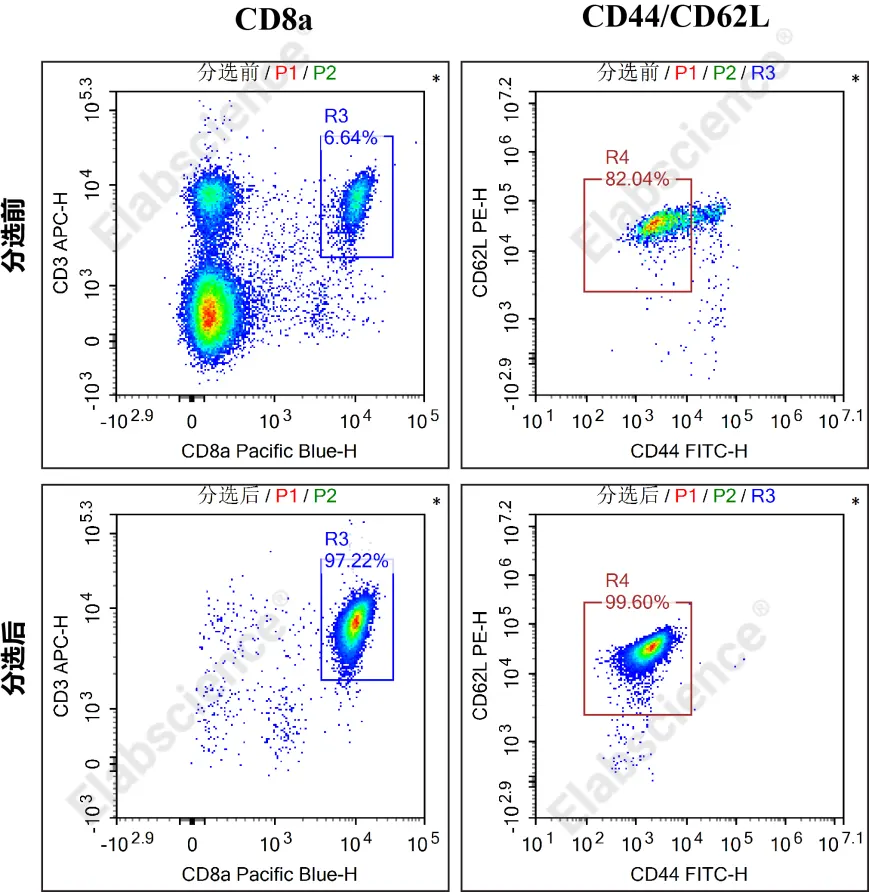
图1. Mouse naïve CD8+T细胞分选前后结果
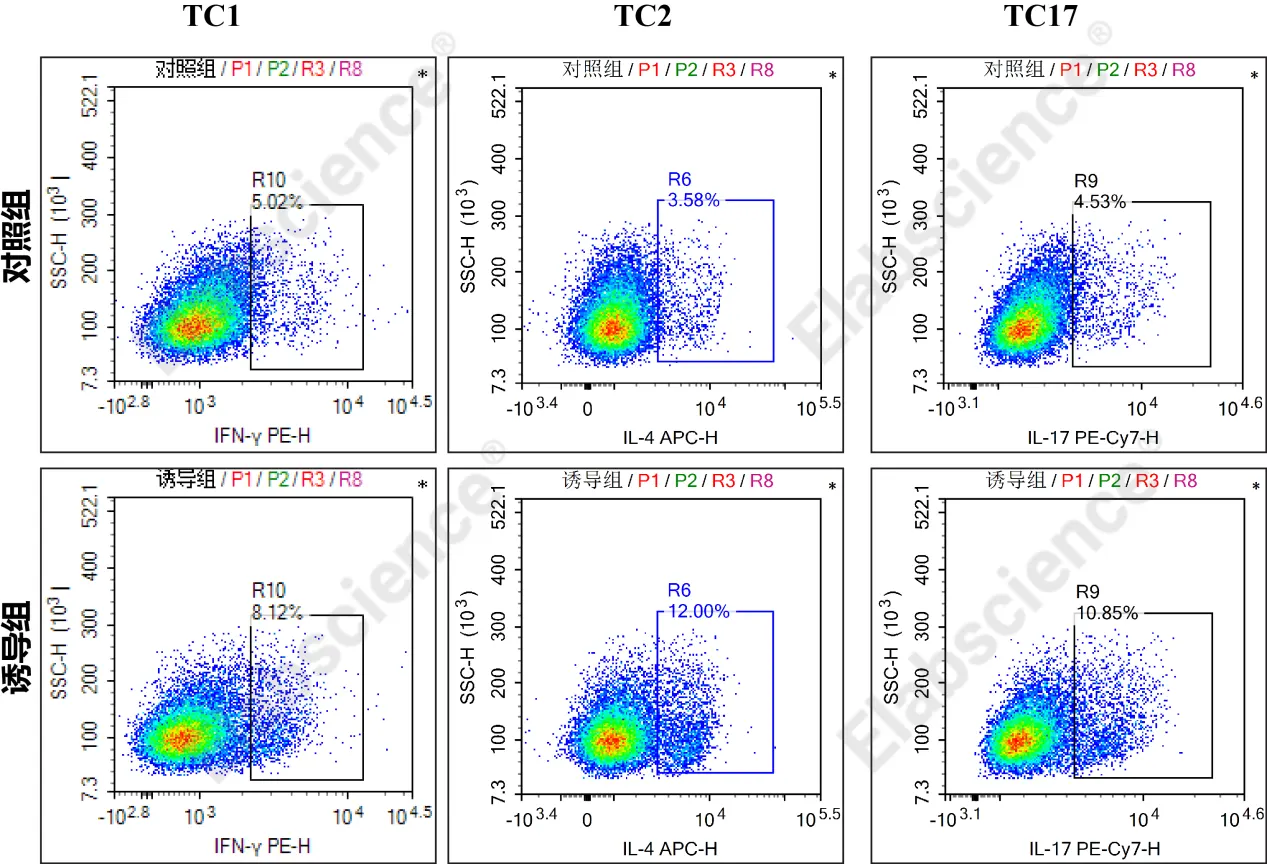
图2. 对照组和诱导组进行Tc1/Tc2/Tc17流式检测
四、常见问题与解决方案
常见问题 | 可能原因 | 解决方案 |
背景信号高 | 抗体交叉反应 | 使用同种型IgG对照抗体排除非特异性结合 |
细胞碎片干扰 | 通过FSC-A vs SSC-A排除碎片,FSC-H vs FSC-A排除双联体细胞 | |
细胞分群不明显或信号弱
| 细胞活性差 | 使用新鲜分离的PBMC或脾细胞,减少冻存影响。 |
固定/破膜步骤破坏表位或胞内细胞因子。 | 选择温和的破膜剂 | |
抗体效价低、荧光衰减或克隆选择不当 | 使用经过验证的高质量抗体 | |
细胞得率低或活性差
| 组织解离不充分 | 机械解离结合酶消化 |
组织保存时间过长 | 使用新鲜样本 | |
流式染色过程中离心力过大 | 染色后离心用200-300×g,5min | |
固定/破膜时间过长 | 严格按照说明书的时间固定/破膜 |
五、核心应用场景
1. 肿瘤免疫治疗:
• Tc1(IFN-γ+)比例高的患者对PD-1/CTLA-4抑制剂响应更佳(如黑色素瘤)。
• Tc17(IL-17+)在部分癌种(如结肠癌)中可能促进免疫抑制微环境。
2. 感染性疾病:
• 病原体特异性免疫评估:
Tc1主导抗病毒免疫。
Tc2通过IL-4协调嗜酸性粒细胞应答。
Tc17通过IL-17激活中性粒细胞防御。
• 疫苗开发:评估疫苗诱导的Tc1记忆细胞形成(如mRNA疫苗)。
3. 自身免疫病研究:
• 多发性硬化(MS)患者脑脊液中Tc17浸润与疾病活动度正相关。
• 类风湿关节炎(RA)中Tc1/Tc17失衡促进关节破坏。
• 靶向IL-17A(司库奇尤单抗)可抑制Tc17的致病作用。
4. 移植免疫监测
• 供体效应CD8+ T细胞中Tc1比例升高预示急性GVHD风险。
•
调节性CD8+ T细胞(与Tc2相关)可能促进耐受。
六.效应CD8+T细胞分型检测Elabscience®相关试剂推荐:
名称 | 货号 |
MIM001A | |
E-AB-F1104Q | |
E-AB-F1013E | |
E-AB-F1100L | |
E-AB-F1011D | |
E-AB-F1353C | |
E-AB-F1013F | |
E-AB-F1101D | |
E-AB-F1204E | |
E-AB-F1272H |
以上就是效应CD8+ T细胞分型检测的实验方案及应用介绍,如有相关问题欢迎留言!【流式课堂】专栏将继续带来T细胞检测干货,请持续关注~






